Cirugías de Reducción de Riesgo: Nuestra Experiencia
Autores
Leal M., Zeff N., Von Stecher F., Paesani F., Tapper K., Crimi G. A.
Departamento de Ginecología y Obstetricia - Hospital Universitario CEMIC

RESUMEN
La cirugía de reducción de riesgo para ciertas poblaciones con mutaciones de genes como el BRCA1/2 debe ser una opción válida y discutida con la paciente al momento del diagnóstico, incluyendo un asesoramiento en cuanto al riesgo de cáncer ginecológico, la disponibilidad de estrategias de prevención y establecer el momento adecuado para realizar una cirugía profiláctica, el impacto sobre la calidad vida, las posibles complicaciones y sus efectos colaterales. Este estudio tiene como objetico describir la casuística de cirugías de reducción de riesgo de cáncer en el departamento de Ginecología y Obstetricia del Hospital Universitario CEMIC desde enero del 2011 hasta diciembre de 2018. Se analizaron las siguientes variables: tipo de cirugía, indicación, fecha de cirugía, edad y resultado anatomopatológico. Se reclutaron un total de 25 pacientes: 18 fueron cirugías ginecológicas y 7 fueron cirugías mamarias. Del grupo de cirugías ginecológicas, solo 1 paciente presentó diagnóstico de carcinoma seroso de ovario de alto grado. Siete pacientes realizaron cirugías de reducción de riesgo mamarias: 6 fueron mastectomías bilaterales y 1 unilateral. Del total de pacientes (25), solo 13 tenían antecedente personal oncológico de cáncer de mama y 8 pacientes fueron estudiadas por antecedentes familiares; 6 de ellas presentaron mutación en el gen BRCA 1/2 únicamente; 1 paciente presentó mutación de MSH2 y BRCA 1; 1 paciente presentó resultado negativo para mutación de BRCA 1/2 pero aun así decidió realizar mastectomía bilateral. Solo una paciente tuvo diagnóstico de Síndrome de Cáncer Gástrico Difuso Hereditario (mutación del gen CDH1) en contexto de cáncer de estómago.
INTRODUCCIÓN
Las cirugías de reducción de riesgo de cáncer han aumentado en los últimos años, principalmente debido a un mayor diagnóstico de mutaciones genéticas que presentan riesgo oncológico elevado.
La decisión de realizar estas cirugías es compleja, debiéndose tener en cuenta distintos aspectos como la edad, paridad, complicaciones quirúrgicas y efectos colaterales a corto y largo plazo, entre otros.
OBJETIVO
Describir la casuística de cirugías de reducción de riesgo de cáncer en el departamento de Ginecología y Obstetricia del Hospital Universitario CEMIC.
MATERIALES Y MÉTODOS
Se realizó una búsqueda de cirugías de reducción de riesgo de cáncer genito-mamario realizadas en el departamento de Ginecología del Hospital Universitario CEMIC desde Enero del 2011 hasta Diciembre de 2018. Se analizaron las siguientes variables: tipo de cirugía, indicación, fecha de cirugía, edad y resultado anatomopatológico.
RESULTADOS
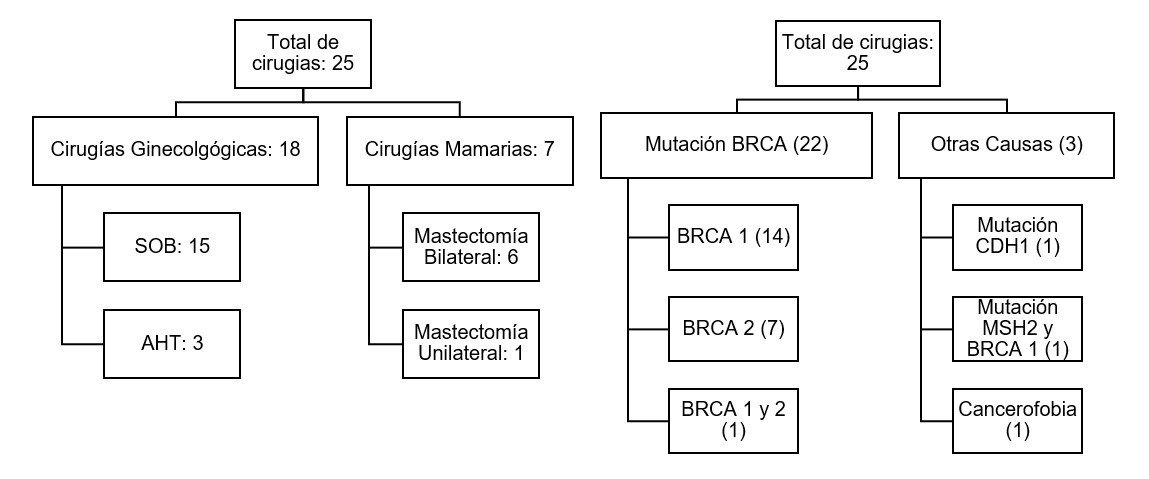
Se reclutaron un total de 25 pacientes: 18 (72%) fueron cirugías ginecológicas y 7 (28%) fueron cirugías mamarias. Del grupo de cirugías ginecológicas, 15 pacientes (83,3%) realizaron salpingooforectomia bilateral (SOB) y 3 (16,6%) realizaron anexohisterectomía con una edad promedio de 46,6 años (mediana: 45 años, rango: 36-70 años). Respecto a la indicación, 12 pacientes (66,6%) presentaban mutación de BRCA 1, 4 (22,2%) presentaban mutación de BRCA 2, 1 (5,5%) presentaba mutación de BRCA 1 y MSH2 y 1 (5,5%) presentaba mutación de BRCA 1 y 2. Dos de 18 pacientes (11,1%) eran menores a 40 años y el resto (88%) eran mayores de 40 años. Una paciente (5,5%) presentó diagnóstico de carcinoma seroso de ovario de alto grado con citología peritoneal positiva. La paciente presentaba antecedente personal de cáncer de tiroides y antecedente familiar de cáncer de ovario, por lo cual fue diagnosticada a los 43 años con una mutación de BRCA 1, realizándose la cirugía de reducción de riesgo ese mismo año. Posteriormente la paciente realizó la citorreducción primaria completa correspondiente. En las 17 pacientes restantes (94.4%) el informe anatomopatológico fue negativo. De la totalidad de las cirugías ginecológicas, 1 se realizó en 2011, 1 en 2014, 5 en 2015, 3 en 2016, 5 en 2017 y 3 en 2018. En cuanto a la paridad, 2/18 (11.1%) de las pacientes son nulíparas, 3/18 (16.6%) tienen 1 parto y13/18 (72.2%) tienen 2 o más partos.
Siete pacientes realizaron cirugías de reducción de riesgo mamarias: 6(85.7%) fueron mastectomías bilaterales y 1 (14,2%) unilateral por ya tener mastectomía previa por indicación oncológica. La edad promedio fue de 38,2 años (rango: 31 a 58 años; mediana: 35,5 años). Respecto a la indicación de la cirugía: 2 pacientes (28,6%) presentaban mutación de BRCA 1, 3 (42,8%) presentaban mutación de BRCA 2, 1 (14,2%) presentaba mutación de CDH1 y 1 (14,2%) realizó mastectomía bilateral por cancerofobia. Ninguna paciente presentó patología maligna en el informe de anatomía patológica. Cinco de 7 pacientes (71,4%) realizaron estudio del ganglio centinela, todos con resultados negativos. De la totalidad de las cirugías mamarias, 1 se realizó en 2011, 1 en 2012, 2 en 2016, 2 en 2017 y 1 en 2018. En cuanto a la paridad, 2/7 (28,6%) son nulíparas, el resto de las pacientes (71,4%) tienen 2 o más partos.
Dentro de las pacientes con mutación de BRCA 1 que realizaron anexectomía bilateral, solo 2/12 (16.6%) presentaban mastectomía bilateral previa. Ambas pacientes tuvieron diagnóstico de cáncer de mama unilateral y mutación de BRCA 1, complementando la cirugía con mastectomía contralateral en el mismo momento del tratamiento oncológico mamario a los 34 y 44 años respectivamente. Por otro lado, de las pacientes que se realizaron mastectomía de reducción de riesgo, solo una presentaba una anexectomía bilateral previa (realizada en otra institución) a los 35 años por mutación de BRCA 1 sin antecedente personal oncológico.
Del total de pacientes (25), 13 (52%) tenían antecedente personal oncológico de cáncer de mama por lo cual se realizó el rastreo de mutación de BRCA 1/2. Ocho pacientes (32%) no presentaba antecedente oncológico personal de ninguna índole, y fueron estudiadas por antecedentes familiares; 6 de ellas (24%) presentaron alguna mutación en el gen BRCA 1/2 únicamente; 1 paciente presentó mutación de MSH2 y BRCA 1; 1 paciente presentó resultado negativo para mutación de BRCA 1/2 luego de ser estudiada por antecedente familiar de cáncer de mama, pero aun así decidió realizar mastectomía bilateral por temor al riesgo aumentado de cáncer de mama. Solo una paciente tuvo diagnóstico de Síndrome de Cáncer Gástrico Difuso Hereditario (mutación del gen CDH1) en contexto de cáncer de estómago a los 42 años, y ese mismo año se realizó la mastectomía bilateral profiláctica.
La Tabla 1 resume las características de las pacientes.
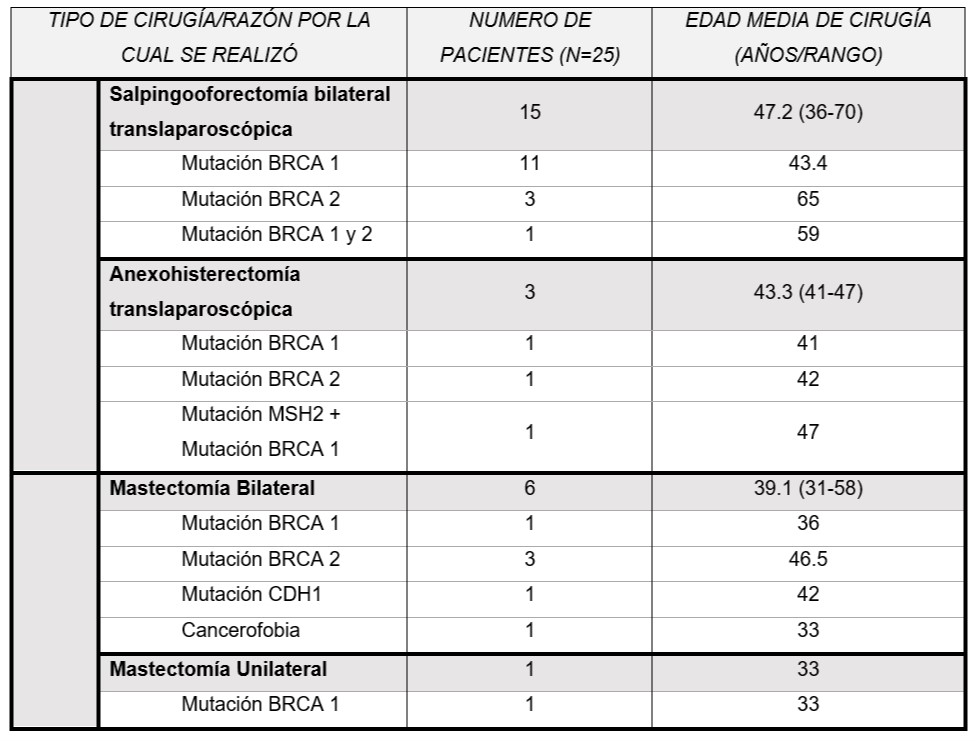
Tabla 1. Características de población
DISCUSIÓN
En los últimos años, y sobre todo a partir de las últimas actualizaciones de guias como la NCCN (National Comprehensive Cancer Network), han aumentado el número de consultas y derivaciones de pacientes hacia especialistas en genética médica; esto último, sumado a la mayor disponibilidad de estudios genéticos para determinar con mayor exactitud la presencia o no de alguna mutación asociada al aumento de riesgo de cáncer ginecológico, harían pensar que la cantidad de cirugías profilácticas han aumentado en los últimos años. En un estudio realizado en el año 2012, se observó que las mujeres con historia familiar sugestiva de cáncer hereditario que habían recibido asesoramiento genético eran más propensas a realizar SOB (38.2 vs. 2.8/1000 pacientes), y que más de la mitad de estas pacientes había realizado algún estudio genético posterior al asesoramiento9. En nuestra casuística se puede observar que, de la totalidad de las cirugías, el 16% se realizaron desde el 2011 al 2014 inclusive, mientras que del periodo 2015 al 2018 se realizó el 84% restante, teniendo el 100% de las pacientes un estudio genético previo a la cirugía (figura 1).
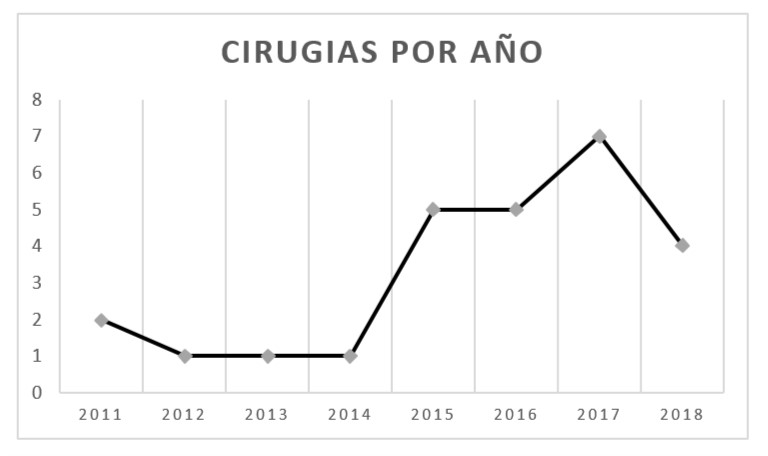
Figura 1. Número de cirugías por año
Actualmente el tamizaje para el cáncer de ovario (ya sea con CA-125 y/o ecografía transvaginal) no está validado debido a la baja sensibilidad y alta tasa de falsos positivos, especialmente en mujeres premenopáusicas3. Las mujeres sin mutación documentada o antecedentes familiares altamente sugestivos de una mutación se consideran pacientes con riesgo habitual para cáncer de ovario, con una incidencia de 1-2% a lo largo de toda la vida, teniendo en cuenta que el 60% de estas pacientes serán diagnosticadas en estadios avanzados, y la sobrevida a los 5 años no supera el 25%. Por el contrario, si el cáncer de ovario es diagnosticado en estadios tempranos, la sobrevida a 10 años puede llegar hasta el 90%. La ausencia de métodos de screening y diagnóstico precoz asociado al mal pronóstico del cáncer de ovario hacen de las cirugías de reducción de riesgo (como la SOB) la única estrategia de prevención primaria en pacientes con aumento de riesgo de dicha enfermedad, como pueden ser las pacientes portadoras de mutaciones en los genes BRCA1/2, CDH1, Síndrome de Lynch, etc. El riesgo de desarrollar cáncer de ovario en pacientes con mutaciones BRCA1/2 es del 40-59% y de 16-18% respectivamente1, siendo la mayoría de los diagnósticos en estadíos avanzados con baja sobrevida a los 10 años. En pacientes con BRCA1, la prevalencia de cáncer de ovario, trompa de Falopio o peritoneal primario diagnosticado posterior a las cirugías de reducción de riesgo es del 1.5% en pacientes menores a 40 años y de 3.8% en pacientes entre 40 y 49 años de edad. Para pacientes con mutación de BRCA2, se identifica un aumento de incidencia entre los 60 y 69 años con un riesgo anual del 0.6%; es por eso que la edad recomendada para realizar la salpingooforectomía bilateral (SOB) es entre 35 a 40 años para portadoras de mutación de BRCA1, y entre 40 a 45 años para las pacientes portadoras de mutación de BRCA2. En la Tabla 2 se puede observar que la edad media de las pacientes con mutación BRCA1 que realizaron cirugía de reducción de riesgo ginecológica fue de 43,2 años y de 53,5 años para las pacientes con mutación de BRCA2. Una sola paciente presentaba mutación de BRCA1 y 2 quien realizó cirugía ginecológica a los 59 años.
Hoy en día se sabe que existe una relación entre el carcinoma seroso intraepitelial tubario (STIC) o el carcinoma seroso invasor oculto en las fimbrias de las trompas de Falopio y carcinoma invasor, habiéndose encontrado estas patologías en pacientes con mutaciones de BRCA1/2 que realizaron SOB profiláctica y hasta en un 60-75% de las pacientes con cáncer de ovario esporádico (no hereditario), de trompas de Falopio y carcinomatosis peritoneal primaria.7Es por esto que contar con un buen estudio anatomopatológico de las piezas quirúrgicas con un protocolo que evalúe las fimbrias de las trompas para maximizar la detección de carcinoma epitelial tubario temprano es de suma importancia. Por otro lado, hay pocos reportes que hayan identificado la presencia de STIC o carcinoma seroso invasor oculto en la trompa de Falopio en pacientes con bajo riesgo para cáncer de ovario y que hayan realizado una SOB por patología benigna.7El Gynaecologic Oncologic Group (GOG-019) en un estudio retrospectivo no randomizado de pacientes con mutación BRCA1/2, reportó una incidencia de carcinoma oculto en piezas quirúrgicas del 4.6% en pacientes con mutación BRCA 1, del 3.5% en pacientes con mutación del BRCA 2 y del 0.5% en pacientes sin mutaciones conocidas.8 En nuestra población, la incidencia diagnóstica de carcinoma en piezas quirúrgicas fue del 5,5%, en una paciente con mutación de BRCA1; el resto de las pacientes no presento patología maligna en la pieza quirúrgica. La mayoría de los carcinomas ocultos se diagnostican en mujeres mayores a 45 años y es hasta 4 veces más frecuente de desarrollarse en mayores de 50 años que en mujeres premenopáusicas.
Está comprobado que la efectividad de la intervención quirúrgica profiláctica en población de alto riesgo de cáncer de ovario reduce el riesgo de cáncer hasta en un 80%, y mortalidad por cualquier causa hasta en un 77%. Así mismo, esta reportado que la SOB reduce el riesgo de cáncer de mama en un 56% y 43% para pacientes con mutación de los genes BRCA 1 y 2 respectivamente debido a una disminución a la exposición hormonal.1
Por lo mencionado previamente, es esencial que la cirugía de reducción de riesgo de cáncer de ovario se trate de la salpingooforectomía bilateral (SOB). No obstante, a pesar de que el riesgo de cáncer de ovario y trompa de Falopio disminuye sustancialmente (96% en pacientes con BRCA mutado) luego de la cirugía, hay que considerar el riesgo residual de desarrollar carcinoma peritoneal primario, aunque éste sea muy bajo (0.8-1%)3.
Si bien hoy se sabe que una mutación en el gen BRCA aumenta el riesgo de cáncer de ovario y mama, algunos autores sugieren que esta mutación (especialmente del gen BRCA1) también se asociaría con carcinomas serosos uterinos (riesgo estimado de 2.6% a 25 años),10 por lo tanto algunas publicaciones plantean la anexohisterectomía total como cirugía de elección en estas pacientes. La exposición a tamoxifeno como tratamiento de cáncer de mama en esta población aún permanece como posible factor confundidor. Se debe considerar, además, que la anexohisterectomía total puede traer riesgos agregados como lesión del tracto urinario o intestinal, sangrado, dolor pelviano, infecciones postoperatorias, disfunción sexual, etc., así como mayor costo y tiempo de hospitalización. En nuestra población, solo 3 pacientes se realizaron anexohisterectomía total por abordaje laparoscópico; 2 pacientes presentaban mutación del gen BRCA1 y 1 de ellas además presentaba mutación del MSH2, y una paciente presentaba mutación del gen BRCA2, siendo el rango de edad entre 41 a 47 años. Ninguna presentó patología maligna en el estudio anatomopatológico. Aun no existe evidencia concluyente para cambiar las guías de recomendación en cuanto a la cirugía de profilaxis, aunque muchos autores recomiendan que la elección de la cirugía (SOB vs. Anexohisterectomía total) debería basarse en la decisión de la paciente y el cirujano.
Con respecto al cáncer de mama, la forma hereditaria corresponde al 5-10% de todos los canceres de mama diagnosticados. La mutación del gen BRCA1/2 es responsable del 40-50% de los casos hereditarios; solo un 10% adicional estaría relacionado a una mutación en los genes TP53, PTEN, PALB2, CHEK2 y STK11, siendo el resto de los canceres debido a mutaciones en otros genes o variantes genéticas raras.
La mastectomía bilateral profiláctica está actualmente solo recomendada para pacientes con mutación de BRCA1/2. Las pacientes con mutación de BRCA1 y 2 presentan mayor riesgo (72% y 69% respectivamente) al de la población general de desarrollar cáncer de mama1. A diferencia del cáncer de ovario, existen estrategias para el tamizaje de cáncer de mama en población con riesgo medio-alto. El tamizaje debería comenzar a los 25 años con RMN anual (sensibilidad 77-94%) y mamografía anual a partir de los 30 años (sensibilidad 33-59%)1,4, aunque debe tenerse en cuenta que el tamizaje esta intencionado para detectar de forma temprana el cáncer de mama y no para su prevención como la cirugía de reducción de riesgo. Por otro lado, la mastectomía bilateral profiláctica reduce la incidencia de cáncer de mama en un 89.5-100%4 tanto para portadoras de mutaciones de BRCA1 como de BRCA2, aunque no pareciera reducir la mortalidad global por otras causas. El momento adecuado para realizar la cirugía deberá acordarse con la paciente, ya que no existe actualmente una edad de recomendación para realizar dicho procedimiento1.Dado que existe un método de screening eficaz con detección temprana del cáncer de mama, es posible que esto influya en la decisión de la paciente de realizarse la cirugía profiláctica. Como se puede observar en nuestra casuística, de la totalidad de la población, la mayoría (72%) fueron cirugías ginecológicas y solo el 28% fueron mastectomías; esto se debe en gran parte a que existen métodos de screening para la detección temprana de cáncer de mama, y también a que no existe una edad recomendada para realizar mastectomía profiláctica. De las 7 pacientes que realizaron mastectomías, 6(85,7%) presentaban mutación de BRCA1/2 o CDH1. Dentro de este grupo de pacientes, la edad promedio de realización de cirugía fue de 39,1 años (rango: 31-58 años); solo una paciente era nuligesta al momento de la cirugía, mientras que el resto presentaba 2 o más gestaciones. Solo una paciente decidió realizarse mastectomía bilateral por cancerofobia debido a antecedente familiar de cáncer de mama, posterior al diagnóstico de no poseer mutación de BRCA1/2.
El porcentaje de carcinoma oculto de mama al momento de la cirugía es bajo (<5%)4, por ende, la biopsia de ganglio centinela al momento de cirugía podría ser opcional pero no mandatorio. En nuestra población, ninguna de las pacientes presentó patología maligna en el estudio de las piezas quirúrgicas, y 5/7 pacientes (71%) de nuestra población que realizaron mastectomías profilácticas también realizaron estudio del ganglio centinela ya sea uni o bilateral, y fueron negativos en todos los casos.
Dentro de las cirugías profilácticas ginecológicas, 12/18 (66,6%) presentaban mutación de BRCA1 solamente con edad promedio de cirugía de 43,2 años (rango: 36-48 años). Dentro de esas pacientes, 2 eran nuligestas (edad de cirugías 45 y 46 años), 1 presentaba 1 gestación y el resto presentaba 2 o más gestaciones. 1/18 (5,5%) presentaba mutación de MSH2 y BRCA1 con edad de cirugía a los 47 años luego de paridad cumplida. 1/18 (5,5%) presentaba mutación de BRCA 1 y 2 con edad de cirugía a los 59 años y paridad cumplida; el diagnóstico de mutación de BRCA en esta paciente se realizó a los 57 años luego del diagnóstico de cáncer de mama tanto personal como familiar. 4/18 (22,2%) presentaban mutación de BRCA2 solamente, con edad promedio de cirugía a los 53,2 años (rango 42-70 años), presentando todas las pacientes más de una gestación.
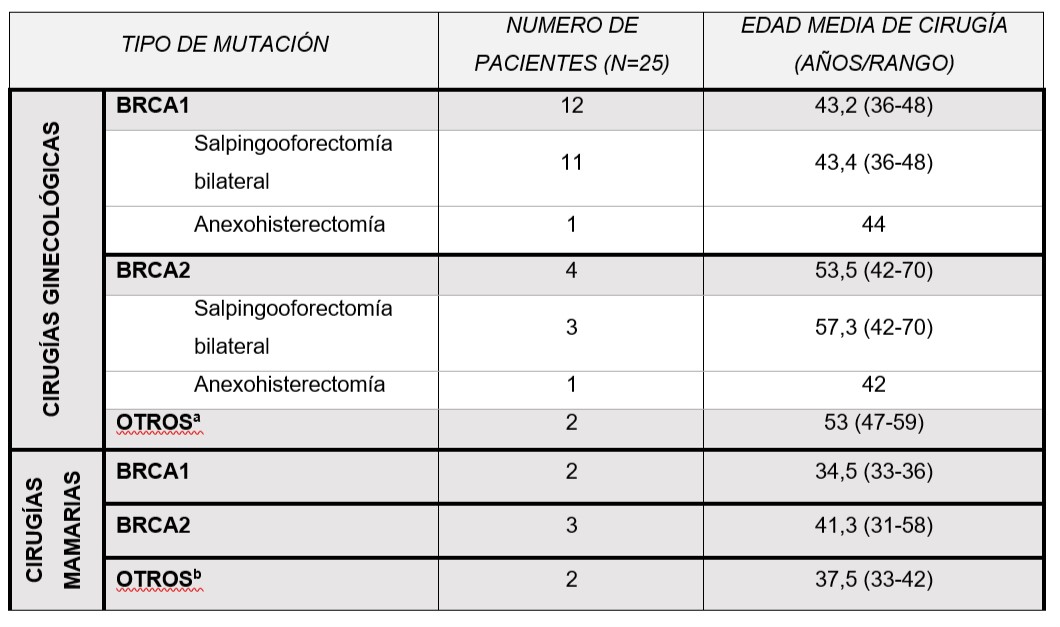
Tabla 2. Edad de cirugía según mutación
aUna paciente presenta mutación para BRCA1 y 2 concomitante y la otra paciente presenta mutación de BRCA1 y MSH2.
b Una paciente presentaba mutación de CDH1 y la otra paciente presentaba solo antecedente familiar de cáncer de mama con estudio de BRCA negativo.
De las otras patologías asociadas a canceres ginecológicos, el Síndrome de Lynch se estima que tiene una incidencia de 1/370 individuos en los Estados Unidos5, y corresponde al 2.3% de todos los canceres endometriales (10% en pacientes <50 años). Las mujeres con este síndrome tienen un riesgo estimado de 30-60% de desarrollar adenocarcinoma de endometrio, especialmente las pacientes con mutación de MSH6, con una edad promedio diagnóstica de 48-62 años; también tienen un riesgo aumentado de cáncer de ovario (12-24%)1. No hay información suficiente para establecer una guía de tamizaje para cáncer de endometrio en estas pacientes, aunque la NCCN sugiere realizar una biopsia endometrial anual hasta completar paridad y posteriormente realizar la anexohisterectomía total6.La paciente que presentaba mutación de MSH2 también presentaba mutación de BRCA1 realizándose una anexohisterectomía a los 47 años.
Pacientes con mutación del gen CDH1 (gen codificante para el Síndrome de Cáncer Gástrico Difuso Hereditario) presentan mayor riesgo que la población general de desarrollar cáncer de mama tipo lobulillar (riesgo acumulado de hasta un 52% a los 75 años), por lo cual se debe considerar realizar screening anual con mamografía y RMN (similar al de pacientes con mutación de BRCA) con posibilidad de ofrecer mastectomía bilateral según antecedente familiar2. En nuestra población, la paciente que presentaba la mutación se realizó la mastectomía a los 42 años.
CONCLUSIONES
La cirugía de reducción de riesgo para ciertas poblaciones con mutaciones de ciertos genes (como el BRCA1/2) debe ser una opción válida y discutida con la paciente al momento del diagnóstico. Se ha observado un aumento de las cirugías profiláctica en los últimos años, lo cual se ve reflejado en nuestra casuística (siendo el 74% de dichas cirugías dentro de los últimos 3 años); esto puede deberse a mayor acceso a la información, tanto del paciente como de los profesionales médicos, con mayor derivación a especialistas para realizar estudios genéticos para mejor evaluación de la paciente. Actualmente debido a las actualizaciones de guías disponibles y debido al incremento al acceso a estudios genéticos, las pacientes pueden contar con un asesoramiento más completo en cuanto a su riesgo de cáncer ginecológico y a la disponibilidad de estrategias de prevención como pueden ser las cirugías profilácticas. Es importante realizar un asesoramiento claro sobre el riesgo de cada paciente de forma individual, estableciendo (de ser necesario) cuando sería el momento adecuado de realizar una cirugía profiláctica, el impacto de la misma sobre su calidad vida, las posibles complicaciones y sus efectos colaterales.
La decisión de realizar la cirugía de reducción de riesgo es compleja y debe ser idealmente realizada en conjunto con un ginecólogo oncólogo, especialmente si la paciente desea realizar la cirugía antes de la edad recomendada. Dentro del asesoramiento se deben explicar los riesgos asociados con la menopausia precoz como la osteoporosis, enfermedad cardiovascular, cambios cognitivos, síntomas vasomotores, disminución de la libido, etc.1Con la información disponible, la paciente puede tomar una decisión con respecto a su riesgo oncológico, paridad, edad y deseo de cirugía profiláctica o control clínico entendiendo los riesgos de cada conducta.
BIBLIOGRAFIA
- NCCN Guidelines Version 2.2019: Genetic/Familial High-Risk Assessment: Breast and Ovarian
- NCCN Guidelines Version 2.2018 Gastric Cancer
- Berek J.S. et al., “Prophylactic and Risk-Reducing Bilateral Salpingo-oophorectomy”, American College of Obstetricians and Gynecologists, 2010
- Ludwig K. K., et al, “Risk reduction and survival benefit of prophylactic surgery in BRCA mutation carriers, a systematic review.”, The American Journal of Surgery, 2016
- Miesfeldt S., “Management of Genetic Syndromes Predisposing to Gynecologic Cancers.”, Current Treatment Options in Oncology, 2013
- NCCN Guidelines Version 2.2019: Uterine Neoplasms
- Reyes Oliver Perez M., “Prophylactic salpingectomy and prophylactic salpingoophorectomy for adnexal high-grade serous epithelial carcinoma: A reappraisal”, Surgical Oncology, 2015
- Sherman M.E., et al., “Pathologic findings at risk-reducing salpingo-oophorectomy: primary results from gynecologic oncology group trial GOG-019.” Clin. Oncol, 2014
- Pocobelli G., et al., “Prophylactic oophorectomy rates in relation to a guideline update on referral to genetic counseling.” Gynecology Oncology, 2012
- Shu, C.A., et al., “Uterine cancer after risk-reducing salpingo-ooforectomy without hysterectomy in women with BRCA mutations.” JAMA, 2016