Istmocele: Una revisión de la literatura
Autores:
MD Paula Camila Godoy-Villamil1, MD Ángela Patricia Caicedo-Goyeneche1, Paula Andrea Mejía-Rodríguez2, Dannia Rosas-Pabón3, Stephanie Patricia Paba-Rojas3
Resumen
Objetivo: Realizar una revisión sistemática sobre istmocele abordando definición, factores de riesgo, prevalencia, clasificación, manifestaciones clínicas, diagnóstico, tratamiento y prevención.
Metodologia: Artículos de revisión y ensayos clínicos en bases de datos como PubMed, UpToDate, Medline, ProQuest, Cochrane, actualizaciones de entidades como la Sociedad Internacional de Ultrasonido en Ginecología y Obstetricia, entre otras. Las restricciones aplicadas fueron estudios en humanos e idiomas (inglés, español y francés).
Resultados: Se incluyeron 55 artículos de revisión y ensayos clínicos.
Conclusiones: El istmocele es una entidad relativamente nueva que surge como consecuencia de las elevadas tasas de cesárea actuales; para su diagnóstico se requiere una alta sospecha clínica en pacientes con manchado posmenstrual, dolor pélvico e infertilidad, asociado al antecedente quirúrgico de cesárea. Existen diversas ayudas diagnósticas y modalidades terapéuticas según las características de la paciente que se deben conocer, con el fin de resolver la sintomatología y mejorar su calidad de vida.
Palabras clave: Istmocele, cicatrices cervicales, diagnóstico, manejo, factores de riesgo.
Abstract:
Objective: To conduct a systematic review on isthmocele addressing definition, risk factors, prevalence, classification, clinical manifestations, diagnosis, treatment and prevention.
Methodology: Review articles and clinical trials in databases such as PubMed, UpToDate, Medline, ProQuest, Cochrane, updates from entities such as the International Society of Ultrasound in Gynecology and Obstetrics, among others. The restrictions applied were human studies and languages (English, Spanish and French).
Result: Fifty-five review articles and clinical trials were included.
Conclusions: Isthmocele is a relatively new entity that arises as a consequence of the current high cesarean section rates; its diagnosis requires a high clinical suspicion in patients with post-menstrual spotting, pelvic pain and infertility, associated with a surgical history of cesarean section. There are several diagnostic aids and therapeutic modalities according to the characteristics of the patient that should be known, in order to resolve the symptoms and improve their quality of life.
Keywords: isthmocele, cervical scars, diagnosis, management and Risk Factors
Introducción
La cesárea es el procedimiento quirúrgico obstétrico más realizado, aún así ha presentado un aumento significativo y global: en América del Sur se estiman prevalencias cercanas al 42%, cifra alta en comparación con lo documentado en América del Norte (32%) y Europa (25%)1. En Colombia, se observa esta tendencia, con tasas del 24,9% en 1998 y 52% en el 20202,3. Según la Organización Mundial de la Salud (OMS) la tasa de cesárea ideal o recomendada oscila entre el 10 al 15%4, porcentaje superado en grandes proporciones.
El aumento en la prevalencia de cesáreas es una situación preocupante ya que con ella parecen aumentar sus complicaciones y consecuencias a mediano y largo plazo. Por su gravedad y necesidad de abordaje inmediato en muchas ocasiones se da mayor importancia a eventos como la dehiscencia de la cicatriz uterina, la placenta previa y el acretismo placentario5, dejando a un lado complicaciones que aunque no tienen desenlaces tan fatales, representan una importante alteración en la calidad de vida de las pacientes como lo es el istmocele.
Material y métodos:
Artículos de revisión y ensayos clínicos en bases de datos como PubMed, UpToDate, Medline, ProQuest, Cochrane, actualizaciones de entidades como la Sociedad Internacional de Ultrasonido en Ginecología y Obstetricia, entre otras. Las restricciones aplicadas fueron estudios en humanos e idiomas (inglés, español y francés).
Resultados:
Definición
No se ha establecido una definición universal de istmocele, descrito por primera vez en 1995 por Morris, quien tras el estudio de 51 muestras de histerectomías determinó cambios patológicos en el área de la cicatriz poscesárea, describiendo la presencia de un pliegue endometrial congestionado en el 61% de las muestras 6. Se ha propuesto que el istmocele hace referencia al defecto iatrogénico de la cicatriz de la cesárea, como pérdida de continuidad miometrial en la pared uterina anterior del sitio de la histerotomía 7,8.
Epidemiología
La prevalencia del istmocele no se conoce con exactitud y está íntimamente relacionada con el método diagnóstico utilizado y la sintomatología evaluada. Se ha reportado un aumento discreto de la prevalencia en mujeres que presentan síntomas (19-84%), cuya molestia principal es el sangrado posmenstrual, en comparación con las pacientes asintomáticas (24-70% )9,10. En un estudio con 263 mujeres evaluadas con ecografía transvaginal (TV) e Histerosonografía (HSG) a las 6 y 12 semanas poscesárea, la prevalencia hallada en el seguimiento con ecografía TV fue del 49% y del 64.5% con HSG11.
Factores de riesgo
Existen diversos factores de riesgo relacionados con los defectos en la cicatriz de la cesárea, los cuales dependen de características propias de la paciente o directamente de la técnica del procedimiento quirúrgico 7.
Se considera que alteraciones en la cicatrización, hemostasia, inflamación, la formación de adherencias e incluso las infecciones postoperatorias, son características propias de la paciente que en su gran mayoría son influenciadas por predisposición genética 12,13. Adicionalmente, se han descrito variables independientes como la diabetes gestacional, cesárea previa, índice de masa corporal (IMC), preeclampsia, hipertensión e incluso la posición en retroversoflexión del útero como factores que de forma significativa aumentan el riesgo para el desarrollo de istmocele.
Dentro de los factores relacionados con la cirugía, se plantean la hipótesis en donde la duración del trabajo de parto, la dilatación, la estación de la presentación y el nivel de la incisión de la histerotomía pueden ser factores predisponentes para el desarrollo de istmocele7, sin embargo, el principal factor de riesgo para su desarrollo continúa siendo el número múltiple de cesáreas 10. Se explicará de forma concisa cada una de estas hipótesis.
Es importante reconocer que la localización baja de la incisión para la histerotomía se relaciona a una cicatrización inadecuada de la herida debido a la presencia de glándulas cervicales, ya que con la producción de moco dificultan la cicatrización y provocan dehiscencia de las capas proximales del miometrio, además predisponen a un mayor tamaño de la lesión tras la formación de quistes de retención14. Otros eventos que influyen son la realización de cesárea en pacientes con más de 5 horas en trabajo de parto, una dilatación mayor a 5 cm o una estación inferior de la presentación que dificulte identificar el lugar adecuado para la incisión entre el cuerpo y el cuello uterino, favoreciendo que se realice la histerotomía a través del tejido cervical 14,15.
Las técnicas de cierre uterino son un tema controversial, hay estudios que consideran que el cierre uterino influye en el desarrollo del istmocele, al punto de pensar que el cierre en una sola capa predispone al cierre incompleto del espesor miometrial 7. En un ensayo clínico se identificó que el 95% de las pacientes a las que se les realizó resección histeroscópica del istmocele, el cierre uterino se llevó a cabo en una sola capa sin cerrar el peritoneo 16. Sin embargo, grandes ensayos como CAESAR y CORONIS que evaluaron más de 3000 y 15.000 pacientes respectivamente, no encontraron diferencias significativas entre ninguna de las intervenciones estudiadas durante las primeras 6 semanas 12,17,18. Por lo anterior, la relación entre el istmocele y la técnica de cierre uterino no se ha aclarado y requiere estudios adicionales antes de recomendar una técnica quirúrgica específica.
Por último, existe una hipótesis de técnicas subóptimas como lo son: la hemostasia inadecuada, la isquemia tisular, la desvascularización y la manipulación excesiva de los tejidos que favorecen la mala cicatrización y el desarrollo de adherencias tempranas entre la herida miometrial y la pared abdominal anterior, aumentando así, el desarrollo del istmocele 12. (Ver tabla 1)
Clasificación
Los hallazgos se pueden clasificar según tamaño, forma o complejidad. Según el tamaño se considera grande si hay una reducción del miometrio en más del 50%-80%, o según el miometrio residual se considera defecto grande cuando es <3mm, o pequeño si es ≥3mm 10,19. Existe un término conocido como rama, el cual hace referencia a un área más delgada que se proyecta desde la lesión principal hacia la serosa, esto permite una clasificación en tres tipos de istmocele: simple, simple con una rama o complejo con más de una rama. (Ver Figura 1). Así mismo, según la sintomatología presente al momento de los hallazgos ecográficos, se puede dividir en asintomáticos o sintomáticos 20,21. De esta manera debe generarse el informe, clasificando el istmocele según los criterios previamente mencionados.
Manifestaciones clínicas
La mayoría de las pacientes no presentan sintomatología y suele ser un hallazgo incidental en las ecografías ginecológicas 22. Dentro de las pacientes sintomáticas se pueden llegar a encontrar complicaciones ginecológicas y obstétricas que se mencionan a continuación.
Complicaciones ginecológicas: El sangrado uterino anormal (SUA) es el principal síntoma, presente en 82% (28.9-82%) de las pacientes con istmocele 23. Al hablar de SUA se deben diferenciar tres presentaciones: la primera de ellas es el manchado posmenstrual, caracterizado por la presencia de secreción vaginal “parduzca” dos o más días luego de haber finalizado la menstruación, dicho síntoma se encuentra en 30-35% de los casos, y está estrechamente relacionado con el tamaño de la lesión11,24; el segundo es el sangrado prolongado, considerado como aquel que supera 8 días de duración, y por último el sangrado intermitente, definido como el sangrado entre el inicio cíclicamente regular de la menstruación 25. Se ha llegado a plantear que el acúmulo de sangre a nivel del defecto miometrial (istmocele) conduce a este tipo de SUA 8,11,23,24.
Dentro de otros síntomas, la dismenorrea (53%), el dolor pélvico (36%) y la dispareunia (18%) han sido descritos24, estableciendo igualmente una relación directa con el tamaño de la lesión. Se cree que dicha sintomatología es secundaria a la infiltración inflamatoria, fibrosis y alteración anatómica del segmento uterino inferior, junto con una “mini contracción” anormal del contenido del defecto 6,14. Teniendo en cuenta que estos síntomas referidos son el motivo de la mayoría de las quejas ginecológicas, es importante considerar el istmocele como un diagnóstico diferencial en aquellas mujeres con antecedente de cesárea 8.
La asociación entre istmocele e infertilidad secundaria ha venido reportándose con una alta prevalencia, se considera que la presencia de restos hemáticos a nivel del defecto o acúmulo de líquido periovulatorio pueden aumentar la densidad del moco cervical, alterar la calidad de los espermatozoides, obstruir el transporte de los mismos y dificultar la implantación, afectando la fertilidad 26,27,28.
Complicaciones obstétricas: el istmocele favorece el desarrollo de complicaciones como placenta previa, acretismo placentario, rotura uterina y embarazo ectópico en la cicatriz uterina 15.
Diagnóstico
Como se mencionó anteriormente, los síntomas están directamente relacionados con el volumen y el tamaño de la lesión, por lo que la medición y una descripción precisa de la misma es importante, dado que el conocimiento de esto permite, no solo un enfoque más integral en el manejo de la sintomatología, sino la planificación de un posible abordaje quirúrgico como tratamiento 23,29.
Hasta el momento no existe una guía estandarizada para su exámen, medición o descripción y no se han logrado establecer criterios definitivos para el diagnóstico del istmocele, sin embargo, existen múltiples alternativas como la ecografía, HSG, histerografía, histeroscopia y la resonancia magnética, las cuales permiten la evaluación de la pared uterina anterior, facilitando el diagnóstico. La mayoría de autores consideran que debe basarse en la presencia de una hendidura en el sitio de la cicatriz de la cesárea con una profundidad de al menos 2 mm 8,10.
Entre los estudios imagenológicos que han demostrado aumento en el diagnóstico del istmocele y fiabilidad intra e interobservador, se encuentra la histerosonografía y la ecografía 3D, sin embargo, también conlleva a diagnósticos más graves de la misma anomalía si se compara con lo informado por una ecografía TV 2D. Un estudio con 102 mujeres permitió evidenciar que el diagnóstico de istmocele se pudo realizar en el 59,8% por ecografía TV, y en el 70,5% por histerosonografía con una buena fuerza de concordancia 30,31. Si se toma a la histeroscopia como el Gold standard para el diagnóstico de istmocele y lo comparamos con la histerosonografía, se evidencia que esta última tiene una sensibilidad del 87%, especificidad del 100%, valor predictivo positivo (VPP) 100%, valor predictivo negativo (VPN) 95% y una precisión del 96%, factores que la hacen confiable y factible 32. Otros métodos propuestos para el diagnóstico del istmocele son la resonancia magnética (RMN) y la histeroscopia. Respecto a la primera, se ha encontrado que las mediciones en RMN del espesor del miometrio residual (RMT) están relacionadas con las evaluaciones obtenidas a través de Ecografía TV y que el rendimiento del diagnóstico por RMN a pesar de ser mejor que el de la ecografía TV, no es estadísticamente significativo 33,19. En lo que concierne a la histeroscopia, es un método que permite la visualización directa y la confirmación del istmocele, el cual es descrito como una discontinuidad de la pared uterina anterior, sin embargo, es posible que no evalúe el espesor de RMT 34,35,35. Lo anterior permite dirigir el enfoque diagnóstico hacia la realización de histerosonografía y ecografía TV.
La ecografía TV actualmente es el examen de primera línea a lo que concierne a ginecología, es un método simple, de bajo costo y no invasivo. Esta es la técnica inicial más comúnmente reportada para identificar istmocele y debe considerarse como la primera opción para el cribado, pues tiene una alta correlación (100%) con la histeroscopia en el diagnóstico de este defecto, por lo cual podría ayudar a descartar otras causas 34. Desde 1990 se han descrito hallazgos como defecto en cuña, protuberancia hacia adentro o hacia afuera de la cicatriz, retracción de la misma o hematoma 36.
La HSG es la técnica más precisa para diagnosticar istmocele, la sensibilidad y la especificidad de ecografía TV en comparación con HSG son 49% y 100%, respectivamente, las lesiones pequeñas suelen pasar desapercibidas en la ecografía TV siendo clínicamente relevantes, por lo tanto, la HSG a las 6-12 semanas posparto es el estudio imagenológico de elección 20.
Actualmente se describen con claridad unas medidas relevantes del istmocele que deben ser obtenidas a través del plano sagital y transversal por medio de una ecografía TV o HSG, dentro estas encontramos: 1) longitud, 2) profundidad, 3) RMT, 4) ancho, 5) espesor de miometrio adyacente, 6) distancia entre el nicho y el pliegue vesicovaginal (VV) y 7) la distancia entre la lesión y el orificio externo. (ver figura 2,3,4,5,6 y 7). En el plano sagital con una concordancia del 100% pueden tomarse las medidas de longitud, profundidad y RMT, mientras que en un plano transversal o axial son de mayor relevancia medidas tales como el ancho y la identificación de ramas o prolongaciones hacia la serosa. Se considera que las distancias entre el istmocele y el pliegue VV, y entre el istmocele y el orificio externo, proporcionan un valor adicional para la planificación de estrategias quirúrgicas futuras por lo que es de vital importancia su medición e informe.
Tratamiento
Existen múltiples alternativas: desde un manejo expectante/conservador o farmacológico, hasta abordajes invasivos laparoscópicos, histeroscópicos, vaginales y por laparotomía 37. Las indicaciones para el tratamiento son claras, solo está indicado en mujeres que presenten sintomatología como SUA, incluyendo el sangrado posmenstrual o infertilidad secundaria, al igual que pacientes con antecedentes de abortos recurrentes y embarazo ectópico en la cicatriz uterina con planes de maternidad en un futuro8. Si el diagnóstico se realiza de manera incidental frente a una mujer asintomática y sin planes de gestación futura, se recomienda manejo expectante/farmacológico, más no intervenciones quirúrgicas 19,22.
Manejo Expectante/Farmacológico
Esta opción terapéutica se brinda a aquellas pacientes en quienes se diagnostica un istmocele pequeño (RMT ≥3 mm)19, el cual consiste en ofrecer manejo hormonal con anticonceptivos orales (ACOs) o dispositivo intrauterino liberador de levonorgestrel (DIU-L).
Existe controversia sobre la efectividad de los ACOs, dada las diferencias en los resultados de múltiples publicaciones. Un estudio realizado por Masahiro Tahara y cols, en donde hacen uso de 0,5 mg de norgestrel + 0,05 mg de etinilestradiol durante ≥3 ciclos de 21 días, logran concluir que el manejo conservador administrado es útil para mejorar el sangrado intermenstrual 38, datos que fueron reproducidos en el estudio realizado por Zhang, quien tras el análisis de 18 mujeres tratadas con 3 ciclos de etinilestradiol (30 μg) y desogestrel (150 mg), evidenciaron períodos menstruales más cortos 39. En contraposición, Thurmond y Florio y cols consideran que los ACOs, tras ser comparados con los resultados de mujeres tratadas con histeroscopia, son una intervención ineficaz 40,41. Sin embargo, a pesar de los resultados contrastantes, se considera que los anticonceptivos orales son adecuados, siempre y cuando no se desee un embarazo o la realización de una intervención quirúrgica 20.
El uso de DIU-L no ha demostrado hasta el momento mayor satisfacción al evaluar la respuesta al tratamiento tras el seguimiento de 6 meses. El estudio realizado por Zhang no evidenció que hubiese mejoría en la duración de los períodos menstruales posteriores 39, por lo que hasta el momento se sigue considerando una intervención ineficaz.
Tratamiento quirúrgico
Este tipo de intervenciones deben considerarse después de haber descartado otras causas posibles de los síntomas presentados, dentro de las opciones quirúrgicas se encuentra la resección del istmocele vía histeroscópica, laparoscópica, vaginal o abdominal por laparotomía.
- Resección histeroscópica o istmoplastia
Esta alternativa se brinda a pacientes sintomáticas, quienes en los datos aportados por la Ecografía TV, la HSG o la RMN el miometrio residual sea ≥ 3 mm y en las que el defecto sea menor del 50% del espesor total de la pared miometrial42. La técnica consiste en que por medio de un resectoscopio y corriente unipolar o bipolar se realice 3 acciones: resecar el borde distal o ambos bordes (distal y proximal) y electrocoagular el fondo del istmocele, con el objetivo de mejorar el drenaje de la sangre menstrual evitando su acúmulo y permitir la coagulación en la superficie del defecto 43,44. Esto inevitablemente llevará a un aumento del tamaño de la lesión.
Múltiples estudios han permitido demostrar resultados favorables en relación al control de la sintomatología. Una revisión sistemática realizada por Abacjew-Chmylko y cols. reportan resultados exitosos de la resección histeroscópica del 85%, en donde el SUA se ha resuelto por completo en el 72,4% de los casos 37. En otra revisión, Mutairi y cols documentan una tasa global de mejoría del 92.8%45 y múltiples estudios describen mejoría sintomática del SUA que oscila entre el 60-100%46,47. En lo que concierne a fertilidad se han reportado tasas de hasta el 50-96% con gestaciones posteriores a la corrección histeroscópica 10,27.
Las complicaciones descritas por la resección histeroscópica del istmocele son principalmente la perforación uterina y lesión vesical, que están íntimamente relacionadas a un RMT menor de 3 mm. También se ha asociado incompetencia cervical y ruptura uterina, como consecuencias de la resección del borde proximal 16,42. Para disminuir la posibilidad de estas complicaciones, se recomienda considerar una resección histeroscópica si el grosor miometrial es >3 mm 19.
1. Reparación Laparoscópica
Esta intervención se reserva para defectos grandes, es decir, istmocele con miometrio residual <3 mm en presencia de síntomas y deseo de fertilidad 19. El procedimiento quirúrgico tiene como finalidad la resección de los bordes del istmocele, extirpar el tejido cicatricial para luego dar el cierre adecuado al defecto por medio de suturas en dos capas 10. Se ha documentado que la laparoscopia no solo permite una mejor visualización e identificación del defecto para su correcta reparación, sino que ha demostrado aumento del grosor miometrial 22. Donnez y col, tras la reparación laparoscópica de 38 istmoceles grandes sintomáticos por medio de escisión con láser de CO2 y cierre en tres capas (2 primeras con Vicryl separadas y la última para cierre de peritoneo con Monocryl en sutura continua) documentan un 93% de efectividad, sin encontrar síntomas en las mujeres tratadas, y hasta un 44% de recuperación en la tasa de fertilidad 48. La recurrencia del defecto posterior a este tipo de intervención varía entre 1.6-33% y la tasa de complicaciones es relativamente baja (1.7%), donde la de mayor incidencia son las adherencias uterovesicales con un 2%42,47,49.
Con base a lo anterior y lo documentado sobre el aumento importante del grosor miometrial, la resección laparoscópica del istmocele se considera efectiva para la restauración de la pared uterina anterior 22.
2. Reparación Vaginal
Este tipo de procedimiento requiere de mayor experticia por parte de los cirujanos, y suele realizarse en aquellas pacientes en las que el defecto es bajo. Desafortunadamente, a pesar de ser una intervención mínimamente invasiva y eficaz los reportes de literatura son escasos 50, 51 . Algunos estudios logran concluir que la técnica TV tiene una eficacia comparable a la reparación laparoscópica, alcanzando cifras de mejoría clínica de 85-93%, grosor miometrial de más de 8.5 mm e incluso tasas de embarazo post tratamiento del 22%10,52,53. La técnica consiste en la disección del espacio VV, lo cual permite la identificación del defecto, procediendo a extirparlo y luego a un cierre de la histerotomía en dos planos o capas. Como beneficios este abordaje cuenta con tiempos quirúrgicos menores y es comparativamente igual o más efectiva que la reparación laparoscópica 52.
3. Uso combinado laparoscopia + procedimiento vaginal
Esta combinación puede llegar a ofrecer ventajas técnicas que permitan mejor visualización del istmocele, de tal manera que se minimice la posibilidad de lesión vesical, utilizando la vía laparoscópica para diseccionar la vejiga del útero y la vía transvaginal para hacer la incisión, extirpar el tejido cicatricial y reparar el defecto 49.
4. Resección por laparotomía
Esta opción se puede brindar a pacientes sintomáticas candidatas a corrección, quienes rechazan el manejo expectante/farmacológico y cuentan con un grosor miometrial <2.2mm. Se ha podido observar en los diferentes estudios una reducción de los síntomas en el 60-100% de los casos, con mejoría en el grosor miometrial de 1.9-8 mm, no obstante, la persistencia del defecto continúa siendo hasta de un 28.5%29,54.
5. Histerectomía
Podría considerarse como el tratamiento curativo del istmocele sintomático grande, en pacientes que no deseen gestaciones futuras 19. Pueden presentarse complicaciones como lesiones vesicales e incluso requerimiento de hemoderivados, sobre todo si se trata de una paciente con múltiples cesáreas 49.
6. Prevención
La prevención primaria inicia por fortalecer las estrategias que permitan minimizar las tasas de cesáreas, y la prevención secundaria se lleva a cabo a través de la adopción de técnicas quirúrgicas correctas que garanticen una menor lesión miometrial y una adecuada cicatrización 20. Un estudio realizado por Ziya Kalem en donde comparan los efectos de dos técnicas de cierre uterino (sistema de doble capa lejos-lejos-cerca-cerca y bloqueo continuo de una sola capa), tras el estudio de 138 mujeres demuestra que el sistema de doble capa puede resultar beneficiosa para reducir la formación de istmocele y asegurar suficiente miometrio residual, al punto de que podría llegar a convertirse en un futuro en la técnica adecuada para el cierre uterino 55.
Conclusión
El istmocele es una entidad relativamente nueva que surge como consecuencia de las elevadas tasas de cesárea actuales; para su diagnóstico se requiere una alta sospecha clínica en pacientes con manchado posmenstrual, dolor pélvico e infertilidad, asociado al antecedente quirúrgico de cesárea. Existen diversas ayudas diagnósticas y modalidades terapéuticas según las características de la paciente que se deben conocer, con el fin de resolver la sintomatología y mejorar su calidad de vida.
Referencias
- Betrán AP, Ye J, Moller AB, Zhang J, Gülmezoglu AM, Torloni MR. The increasing trend in caesarean section rates: Global, regional and national estimates: 1990-2014. PLoS One. 2016;11(2):1-12. doi:10.1371/journal.pone.0148343
- Munñoz-Molina M, Poo-Figueroa AM, Bustos-Medina L, Baeza-Weinmann B. Agreement among three examiners and one expert in the detection of mother-infant attachment risk during the postpartum period, Temuco, IX region, Chile, 2010. Rev Colomb Obstet Ginecol. 2014;65(2):129-137. doi:10.18597/rcog.61
- Dep Adm Nac Estadística (DANE) Nacimientos 2019. 2019;Cuadro 4.
- World Health Organization Human Reproduction Programme WHO statement on caesarean section rates. Reprod Health Matters. 2015;23(45):149–150. doi: 10.1016/j.rhm.2015.07.007.
- Gonzalez N, Tulandi T. Cesarean Scar Pregnancy: A Systematic Review. J Minim Invasive Gynecol. 2017;24(5):731-738. doi:10.1016/j.jmig.2017.02.020
- Morris H. Surgical pathology of the lower uterine segment caesarean section scar: is the scar a source of clinical symptoms? Int J Gynecol Pathol. 1995; 14(1), 16-20. doi:10.1097 / 00004347-199501000-00004
- Bij De Vaate AJM, Van Der Voet LF, Naji O y cols. Prevalence, potential risk factors for development and symptoms related to the presence of uterine niches following Cesarean section: Systematic review. Ultrasound Obstet Gynecol. 2014;43(4):372-382. doi:10.1002/uog.13199
- Tower AM, Frishman GN. Cesarean scar defects: An underrecognized cause of abnormal uterine bleeding and other gynecologic complications. J Minim Invasive Gynecol. 2013;20(5):562-572. doi:10.1016/j.jmig.2013.03.008
- Naji O, Abdallah Y, Bij De Vaate AJ y cols. Standardized approach for imaging and measuring Cesarean section scars using ultrasonography. Ultrasound Obstet Gynecol. 2012;39(3):252-259. doi:10.1002/uog.10077
- Tulandi T, Cohen A. Emerging manifestations of cesarean scar defect in reproductive-aged women. J Minim Invasive Gynecol. 2016;23(6):893-902. doi:10.1016/j.jmig.2016.06.020
- Van Der Voet LF, Bij De Vaate AM, Veersema S, Brölmann HAM, Huirne JAF. Long-term complications of caesarean section. the niche in the scar: A prospective cohort study on niche prevalence and its relation to abnormal uterine bleeding. BJOG An Int J Obstet Gynaecol. 2014;121(2):236-244. doi:10.1111/1471-0528.12542
- Vervoort AJMW, Uittenbogaard LB, Hehenkamp WJK, Brölmann HAM, Mol BWJ, Huirne JAF. Why do niches develop in Caesarean uterine scars? Hypotheses on the aetiology of niche development. Hum Reprod. 2015;30(12):2695-2702. doi:10.1093/humrep/dev240
- Buhimschi CS, Zhao G, Sora N, Madri JA, Buhimschi IA. Myometrial wound healing post-cesarean delivery in the MRL/MPJ mouse model of uterine scarring. Am J Pathol. 2010;177(1):197-207. doi:10.2353/ajpath.2010.091209
- Vikhareva Osser O, Jokubkiene L, Valentin L. Cesarean section scar defects: Agreement between transvaginal sonographic findings with and without saline contrast enhancement. Ultrasound Obstet Gynecol. 2010;35(1):75-83. doi:10.1002/uog.7496
- Futyma K, Gałczyński K, Romanek K, Filipczak A, Rechberger T. When and how should we treat cesarean scar defect - isthmocoele? Ginekol Pol. 2016;87(9):664-668. doi:10.5603/GP.2016.0063
- Vervoort AJMW, Van der Voet LF, Witmer M y cols. The HysNiche trial: Hysteroscopic resection of uterine cesarean scar defect (niche) in patients with abnormal bleeding, a randomised controlled trial. BMC Womens Health. 2015;15(1):1-9. doi:10.1186/s12905-015-0260-8
- Group TCC. Caesarean section surgical techniques (CORONIS): A fractional, factorial, unmasked, randomised controlled trial. Lancet. 2013;382(9888):234-248. doi:10.1016/S0140-6736(13)60441-9
- CAESAR Study Collaborative Group. Caesarean section surgical techniques: A randomised factorial trial (CAESAR). BJOG An Int J Obstet Gynaecol. 2010;117(11):1366-1376. doi:10.1111/j.1471-0528.2010.02686.x
- Marotta ML, Donnez J, Squifflet J, Jadoul P, Darii N, Donnez O. Laparoscopic repair of post-cesarean section uterine scar defects diagnosed in nonpregnant women. J Minim Invasive Gynecol. 2013;20(3):386-391. doi:10.1016/j.jmig.2012.12.006
- Kulshrestha V, Agarwal N, Kachhawa G. Post-caesarean Niche (Isthmocele) in Uterine Scar: An Update. J Obstet Gynecol India. 2020;70(6):440-446. doi:10.1007/s13224-020-01370-0
- Jordans IPM, De Leeuw RA., Stegwee SÍ y cols. Sonographic examination of uterine niche in non- pregnant women: a modified Delphi procedure. Ultrasound Obstet Gynecol. 2019;53(1):107-115. doi:10.1002/uog.19049
- Sipahi S, Sasaki K, Miller CE. The minimally invasive approach to the symptomatic isthmocele - What does the literature say? A step-by-step primer on laparoscopic isthmocele - excision and repair. Curr Opin Obstet Gynecol. 2017;29(4):257-265. doi:10.1097/GCO.0000000000000380
- Bij De Vaate AJM, Brölmann HAM, Van Der Voet LF, Van Der Slikke JW, Veersema S, Huirne JAF. Ultrasound evaluation of the Cesarean scar: Relation between a niche and postmenstrual spotting. Ultrasound Obstet Gynecol. 2011;37(1):93-99. doi:10.1002/uog.8864
- Wang CB, Chiu WWC, Lee CY, Sun YL, Lin YH, Tseng CJ. Cesarean scar defect: Correlation between Cesarean section number, defect size, clinical symptoms and uterine position. Ultrasound Obstet Gynecol. 2009;34(1):85-89. doi:10.1002/uog.6405
- Munro MG, Critchley HOD, Fraser IS y cols. The two FIGO systems for normal and abnormal uterine bleeding symptoms and classification of causes of abnormal uterine bleeding in the reproductive years: 2018 revisions. Int J Gynecol Obstet. 2018;143(3):393-408. doi:10.1002/ijgo.12666
- Gubbini G, Centini G, Nascetti D y cols. Surgical hysteroscopic treatment of cesarean-induced isthmocele in restoring fertility: Prospective Study. J Minim Invasive Gynecol. 2011;18(2):234-237. doi:10.1016/j.jmig.2010.10.011
- Florio P, Filippeschi M, Moncini I, Marra E, Franchini M, Gubbini G. Hysteroscopic treatment of the cesarean-induced isthmocele in restoring infertility. Curr Opin Obstet Gynecol. 2012;24(3):180-186. doi:10.1097/GCO.0b013e3283521202
- Gurol-Urganci I, Cromwell DA, Mahmood TA, Van Der Meulen JH, Templeton A. A population-based cohort study of the effect of Caesarean section on subsequent fertility. Hum Reprod. 2014;29(6):1320-1326. doi:10.1093/humrep/deu057
- Schepker N, Garcia-Rocha GJ, von Versen-Höynck F, Hillemanns P, Schippert C. Clinical diagnosis and therapy of uterine scar defects after caesarean section in non-pregnant women. Arch Gynecol Obstet. 2015;291(6):1417-1423. doi:10.1007/s00404-014-3582-0
- Alalfy M, Osman OM, Salama S y cols. Evaluation of the cesarean scar niche in women with secondary infertility undergoing ICSI using 2D sonohysterography versus 3D sonohysterography and setting a standard criteria; alalfy simple rules for scar assessment by ultrasound to prevent health problems for the women. Int J Womens Health. 2020;12:965-974. doi:10.2147/IJWH.S267691
- Rasheedy R, Sammour H, Elkholy A, Fadel E. Agreement between transvaginal ultrasound and saline contrast sonohysterography in evaluation of cesarean scar defect. J Gynecol Obstet Hum Reprod. 2019;48(10):827-831. doi:10.1016/j.jogoh.2019.05.013
- El-Mazny A, Abou-Salem N, El-Khayat W, Farouk A. Diagnostic correlation between sonohysterography and hysteroscopy in the assessment of uterine cavity after cesarean section. Middle East Fertil Soc J. 2011;16(1):72-76. doi:10.1016/j.mefs.2010.07.015
- Gupta T, Singal K, Gupta N, Kohli S, Kanyal M. Comparative Study of USG and MRI in Evaluation of Isthmocele. J Obstet Gynecol India. 2021;71(3):292-296. doi:10.1007/s13224-021-01433-w
- Fabres C, Aviles G, De La Jara C y cols. The cesarean delivery scar pouch: clinical implications and diagnostic correlation between transvaginal sonography and hysteroscopy. J Ultrasound Med. 2003;22(7): 695-700. doi: 10.7863/jum.2003.22.7.695.
- Raimondo G, Grifone G, Raimondo D, Seracchioli R, Scambia G, Masciullo V. Hysteroscopic treatment of symptomatic cesarean-induced isthmocele: A prospective study. J Minim Invasive Gynecol. 2015;22(2):297-301. doi:10.1016/j.jmig.2014.09.011
- Chen HY, Chen SJ, Hsieh FJ. Observation of cesarean section scar by transvaginal ultrasonography. Ultrasound Med Biol. 1990;16(5):443-447. doi:10.1016/0301-5629(90)90166-A
- Abacjew-Chmylko A, Wydra DG, Olszewska H. Hysteroscopy in the treatment of uterine cesarean section scar diverticulum: A systematic review. Adv Med Sci. 2017;62(2):230-239. doi:10.1016/j.advms.2017.01.004
- Tahara M, Shimizu T, Shimoura H. Preliminary report of treatment with oral contraceptive pills for intermenstrual vaginal bleeding secondary to a cesarean section scar. Fertil Steril. 2006;86(2):477-479. doi:10.1016/j.fertnstert.2006.01.020
- Zhang X, Yang M, Wang Q, Chen J, Ding J, Hua K. Prospective evaluation of five methods used to treat cesarean scar defects. Int J Gynecol Obstet. 2016;134(3):336-339. doi:10.1016/j.ijgo.2016.04.011
- Florio P, Gubbini G, Marra E y cols. A retrospective case-control study comparing hysteroscopic resection versus hormonal modulation in treating menstrual disorders due to isthmocele. Gynecol Endocrinol. 2011;27(6):434-438. doi:10.3109/09513590.2010.495431
- Thurmond AS, Harvey WJ, Smith SA. Cesarean section scar as a cause of abnormal vaginal bleeding: Diagnosis by sonohysterography. J Ultrasound Med. 1999;18(1):13-16. doi:10.7863/jum.1999.18.1.13
- Palareti G, Legnani C, Cosmi B y cols.. Comparison between different D-Dimer cutoff values to assess the individual risk of recurrent venous thromboembolism: Analysis of results obtained in the DULCIS study. Int J Lab Hematol. 2016;38(1):42-49. doi:10.1111/ijlh.12426
- Li C, Guo Y, Liu Y, Cheng J, Zhang W. Hysteroscopic and laparoscopic management of uterine defects on previous cesarean delivery scars. J Perinat Med. 2014;42(3):363-370. doi:10.1515/jpm-2013-0081
- Torre A, Verspyck E, Hamamah S y cols.Isthmocèle: définition, diagnostic, facteurs de risque, prévention, symptômes, complications, et traitements. Gynecol Obstet Fertil Senol. 2021; 49(11): 858-868. doi:10.1016/j.gofs.2021.06.003
- Al Mutairi BH, Alrumaih I. Hysteroscopy in the treatment of myometrial scar defect (diverticulum) following cesarean section delivery: A systematic review and meta-analysis. Cureus. 2020;12(11). doi:10.7759/cureus.11317
- Mashiach R, Burke YZ. Optimal isthmocele management: hysteroscopic, laparoscopic, or combination. J Minim Invasive Gynecol. 2021;28(3):565-574. doi:10.1016/j.jmig.2020.10.026
- Vitale SG, Ludwin A, Vilos GA y cols.From hysteroscopy to laparoendoscopic surgery: what is the best surgical approach for symptomatic isthmocele? A systematic review and meta-analysis. Arch Gynecol Obstet. 2020;301(1):33-52. doi:10.1007/s00404-020-05438-0
- Donnez O, Donnez J, Orellana R, Dolmans MM. Gynecological and obstetrical outcomes after laparoscopic repair of a cesarean scar defect in a series of 38 women. Fertil Steril. 2017;107(1):289-296.e2. doi:10.1016/j.fertnstert.2016.09.033
- Donnez O. Cesarean scar defects: management of an iatrogenic pathology whose prevalence has dramatically increased. Fertil Steril. 2020;113(4):704-716. doi:10.1016/j.fertnstert.2020.01.037
- Luo L, Niu G, Wang Q, Xie HZ, Yao SZ. Vaginal repair of cesarean section scar diverticula. J Minim Invasive Gynecol. 2012;19(4):454-458. doi:10.1016/j.jmig.2012.03.012
- Chen Y, Chang Y, Yao S. Transvaginal management of cesarean scar section diverticulum: A novel surgical treatment. Med Sci Monit. 2014;20:1395-1399. doi:10.12659/MSM.890642
- Zhang Y. A comparative study of transvaginal repair and laparoscopic repair in the management of patients with previous cesarean scar defect. J Minim Invasive Gynecol. 2016;23(4):535-541. doi:10.1016/j.jmig.2016.01.007
- Zhou J, Yao M, Wang H, Tan W, Chen P, Wang X. Vaginal repair of cesarean section scar diverticula that resulted in improved postoperative menstruation. J Minim Invasive Gynecol. 2016;23(6):969-978. doi:10.1016/j.jmig.2016.06.013
- Pomorski M, Fuchs T, Rosner-Tenerowicz A, Zimmer M. Sonographic evaluation of surgical repair of uterine cesarean scar defects. J Clin Ultrasound. 2017;45(8):455-460. doi:10.1002/jcu.22449
- Kalem Z, Kaya AE, Bakırarar B, Basbug A, Kalem MN. An optimal uterine closure technique for better scar healing and avoiding isthmocele in cesarean section: A randomized controlled study. J Investig Surg. 2021;34(2):148-156. doi:10.1080/08941939.2019.1610530
ANEXOS:
LISTADO TABLAS:
Tabla I. Factores de riesgo para el defecto de la cicatriz uterina
LISTADO IMAGENES:
Figura 1: Diagrama esquemático de un istmocele.
Figura 2: Istmocele principal y pliegue vesicovaginal.
Figura 3: Longitud del istmocele.
Figura 4: Profundidad del istmocele.
Figura 5: Espesor miometrial residual (EMR).
Figura 6: Espesor del miometrio adyacente (EMA).
Figura 7: Distancia entre la lesión y el pliegue vesicovaginal (VV).
Figura 8: Distancia entre la lesión y el orificio externo.
Figura 9: Posición de los calibradores para la medición ecográfica del ancho del istmocele en el plano transversal.
Tabla I. Factores de riesgo para el defecto de la cicatriz uterina
|
No modificables ● Edad Materna ≤ 30 años* ● Útero en retroversión* |
|
Relacionados con el Trabajo de parto ● Duración > 5 horas* ● Cesárea con dilatación ≥ 5 cm* ● Baja estación al momento de la cesárea* ● Uso de Oxitocina* |
|
Relacionados con la Técnica quirúrgica ● Incisión cervical* ● Exclusión del endometrio* ● Cierre en un solo plano** ● Suturas de absorción retardada** ● Cierre muy isquémico** |
|
*Evidencia Respaldada ** Sugerido, pero evidencia insuficiente |
Fuente: Tower AM, Frishman GN. Cesarean Scar Defects: An Underrecognized Cause of Abnormal Uterine Bleeding and Other Gynecologic Complications. J Minim Invasive Gynecol. 2013;20(5):562-572. doi:10.1016/j.jmig.2013.03.008
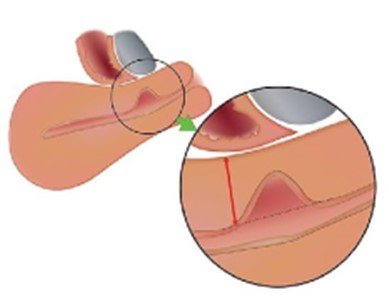
Figura 1. Diagrama esquemático de un istmocele.
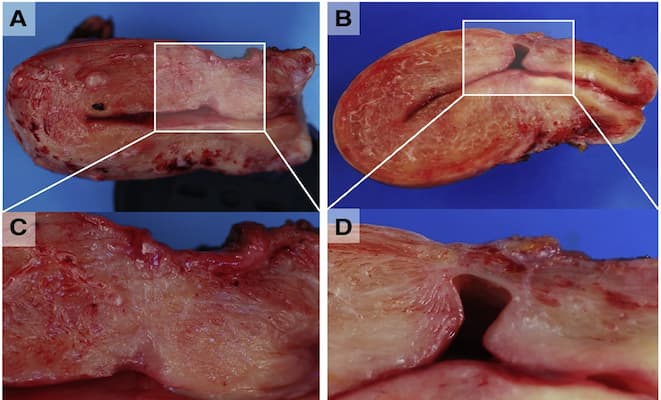
(A) Vista sagital de una sección congelada de una muestra de histerectomía. Se observa una depresión poco profunda cubierta por una gruesa capa de miometrio (rectángulo) a nivel del supuesto lugar de la cesárea (CS). (B) Vista sagital de una sección congelada de una muestra de histerectomía. Se observa un defecto anterior profundo cubierto por una fina capa de miometrio (rectángulo) a nivel del supuesto lugar de la cesárea. (C) Vista ampliada de la depresión poco profunda de A. (D) Vista ampliada del defecto anterior profundo de B.
Tomado de: Donnez O. Cesarean scar defects: management of an iatrogenic pathology whose prevalence has dramatically increased. Fertil Steril. 2020;113(4):704-716. doi:10.1016/j.fertnstert.2020.01.037
Figura 2. Istmocele principal y pliegue vesicovaginal.
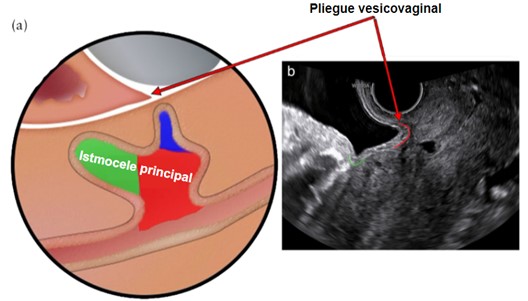
(a) Las áreas rojas y verdes representan el istmocele principal y el área azul representa la rama. (b) La línea verde indica plica vesicouterina o pliegue uterovesical, mientras que la línea roja indica pliegue vesicovaginal.
Tomado de: Jordans, I. P. M., De Leeuw, R. A., Stegwee, S. I., Amso, N. N., Barri‐Soldevila, P. N., Van Den Bosch, T. et al. Sonographic examination of uterine niche in non- pregnant women: a modified Delphi procedure. Ultrasound Obstet Gynecol. 2019;53(1):107-115. doi:10.1002/uog.19049
Figura 3. Longitud del istmocele.
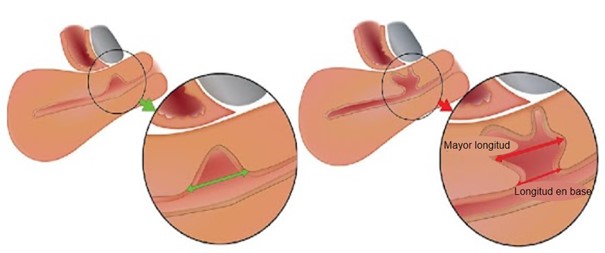
Deben medirse tanto la longitud mayor como la longitud en la base del istmocele.
Tomado de: Jordans, I. P. M., De Leeuw, R. A., Stegwee, S. I., Amso, N. N., Barri‐Soldevila, P. N., Van Den Bosch, T. et al. Sonographic examination of uterine niche in non- pregnant women: a modified Delphi procedure. Ultrasound Obstet Gynecol. 2019;53(1):107-115. doi:10.1002/uog.19049
Figura 4. Profundidad del istmocele.
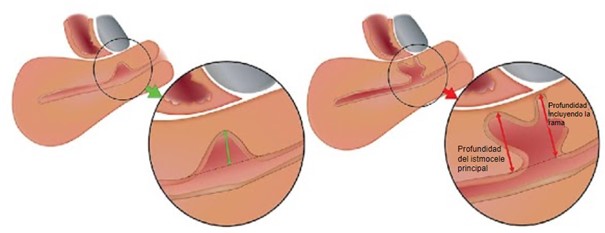
Debe medirse la mayor profundidad, tanto del istmocele principal como de la rama más profunda si hay ramas.
Tomado de: Jordans, I. P. M., De Leeuw, R. A., Stegwee, S. I., Amso, N. N., Barri‐Soldevila, P. N., Van Den Bosch, T. et al. Sonographic examination of uterine niche in non- pregnant women: a modified Delphi procedure. Ultrasound Obstet Gynecol. 2019;53(1):107-115. doi:10.1002/uog.19049
Figura 5. Espesor miometrial residual (EMR).
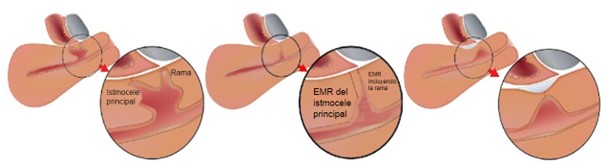
El punto más delgado del EMR debe medirse, independientemente de la dirección (medido perpendicularmente a la serosa, pero no necesariamente a la cavidad uterina), tanto desde el istmocele principal como, si hay ramas, desde la rama con el EMR más delgado. La fibrosis no se incluye en la medición de la EMR.
Tomado de: Jordans, I. P. M., De Leeuw, R. A., Stegwee, S. I., Amso, N. N., Barri‐Soldevila, P. N., Van Den Bosch, T. et al. Sonographic examination of uterine niche in non- pregnant women: a modified Delphi procedure. Ultrasound Obstet Gynecol. 2019;53(1):107-115. doi:10.1002/uog.19049
Figura 6. Espesor del miometrio adyacente (EMA).
El EMA debe medirse cerca del nicho, donde el miometrio es más grueso.
Tomado de: Jordans, I. P. M., De Leeuw, R. A., Stegwee, S. I., Amso, N. N., Barri‐Soldevila, P. N., Van Den Bosch, T. et al. Sonographic examination of uterine niche in non- pregnant women: a modified Delphi procedure. Ultrasound Obstet Gynecol. 2019;53(1):107-115. doi:10.1002/uog.19049
Figura 7. Distancia entre la lesión y el pliegue vesicovaginal (VV).
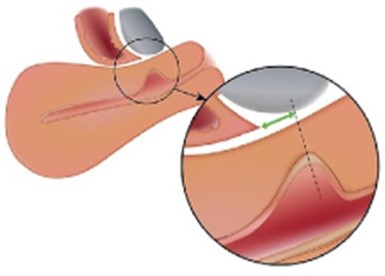
La distancia entre el istmocele y el pliegue vesicovaginal debe medirse desde el nivel de la parte superior del istmocele principal (donde el grosor del miometrio residual es menor (línea de puntos)) hasta el pliegue vesicovaginal.
Tomado de: Jordans, I. P. M., De Leeuw, R. A., Stegwee, S. I., Amso, N. N., Barri‐Soldevila, P. N., Van Den Bosch, T. et al. Sonographic examination of uterine niche in non- pregnant women: a modified Delphi procedure. Ultrasound Obstet Gynecol. 2019;53(1):107-115. doi:10.1002/uog.19049
Figura 8. Distancia entre la lesión y el orificio externo.
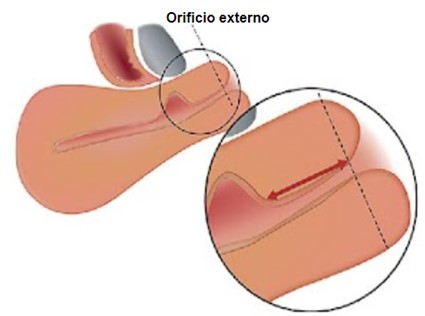
La distancia entre el nicho y el orificio externo debe medirse en paralelo al canal cervical, desde el punto más distal del nicho hasta el orificio externo.
Tomado de: Jordans, I. P. M., De Leeuw, R. A., Stegwee, S. I., Amso, N. N., Barri‐Soldevila, P. N., Van Den Bosch, T. et al. Sonographic examination of uterine niche in non- pregnant women: a modified Delphi procedure. Ultrasound Obstet Gynecol. 2019;53(1):107-115. doi:10.1002/uog.19049
Figura 9. Posición de los calibradores para la medición ecográfica del ancho del istmocele en el plano transversal.
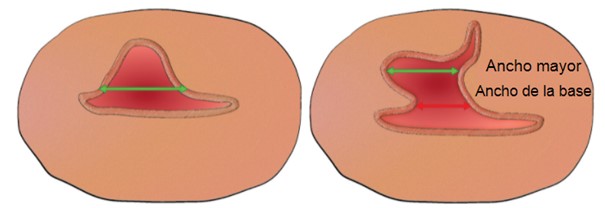
Deben medirse tanto el ancho mayor como el ancho en la base del istmocele.
Jordans, I. P. M., De Leeuw, R. A., Stegwee, S. I., Amso, N. N., Barri‐Soldevila, P. N., Van Den Bosch, T. et al. Sonographic examination of uterine niche in non- pregnant women: a modified Delphi procedure. Ultrasound Obstet Gynecol. 2019;53(1):107-115. doi:10.1002/uog.19049
Derechos de autor
Los abajo firmantes estamos conformes con lo mencionado en los incisos previos.
Título del artículo: Istmocele: Una revisión de la literatura
Nombre completo de los autores:
- Paula Camila Godoy Villamil
- Angela Patricia Caicedo Goyeneche
- Paula Andrea Mejía Rodríguez
- Dannia Rosas Pabón
- Stephanie Patricia Paba Rojas
Los autores aseguran qué se trata de un trabajo original, qué no infringe ningún derecho de autor o propiedad intelectual de un tercero, qué no está bajo consideración de otra publicación, no ha sido previamente publicado ni enviado para su publicación a otra revista y qué su contenido esencial, tablas e ilustraciones no han sido previamente publicados.
Los autores manifiestan qué no existe conflicto de intereses con otras instancias públicas o privadas.
Los autores están de acuerdo en qué su texto sea corregido de acuerdo con el criterio de los editores y en transferir todo el derecho de propiedad intelectual a la Revista FASGO en el momento en el qué el trabajo sea publicado.
- Los autores confirman que el manuscrito final ha sido leído y aprobado.
-
Residente de Ginecología & Obstetricia de la Universidad Autónoma de Bucaramanga
-
Estudiante de pregrado VI año de medicina, Facultad de Ciencias de la Salud, Universidad Autónoma de Bucaramanga, Colombia.
-
Estudiante de pregrado V año de medicina, Facultad de Ciencias de la Salud, Universidad Autónoma de Bucaramanga, Colombia.