Evaluación de la Obesidad en Mujeres con Cáncer de Mama
Autores:
Vidallé D, Alonso ME, Botek E, Pendino A, Altuna P, Zwenger Y.(1)
Resumen
La obesidad (OB) está asociada con cambios sistémicos que se han relacionado con la patogénesis del cáncer de mama. Actualmente, el índice de masa corporal (IMC) es la medida de obesidad más utilizada en los ensayos clínicos. Sin embargo, se ha informado que los trastornos del síndrome metabólico que se asocian clásicamente con un IMC elevado ocurren en un subconjunto de personas con un IMC normal. Además, el IMC no refleja la composición corporal. El objetivo principal fue determinar la correlación entre las diferentes definiciones de obesidad: la obesidad por IMC (OB IMC), la obesidad metabólica (OB MTB) y la obesidad por el porcentaje de grasa corporal (OB PGC) en mujeres con cáncer de mama y su correlación.
Los objetivos secundarios incluyeron analizar la obesidad según las características moleculares y pronósticas del cáncer de mama. Se realizó el análisis de antropometría (AM) para determinar el PGC, el IMC y sangre en ayunas de mujeres al diagnóstico del cáncer de mama. La obesidad metabólica se consideró cuando presentaban por lo menos tres de los siguientes criterios: circunferencia de cintura ≥88cm, glicemia en ayunas ≥100mg/dl, tensión arterial ≥130/85, triglicéridos en ayunas ≥150 mg/dl y lipoproteina del colesterol de alta densidad (HDL) <50 mg/dl. Según el IMC si era ≥ a 30 kg/m2 y el PGC ≥32%. Inferimos que el IMC, el PGC y el estado MTB no miden de la misma manera a la obesidad (p < 0,0001). Es probable que utilizando el IMC se produzca una clasificación errónea del riesgo cardiometabólico y oncológico. El PGC refleja un estado metabólicamente obeso y podría ser más predictivo del riesgo de cáncer de mama independientemente del IMC. Dada la importancia de este factor de riesgo, no solo por influir en la incidencia de cáncer de mama, sino también por su asociación con peores resultados clínicos después del diagnóstico, es crucial caracterizarlo con mayor precisión.
Palabras claves: Cáncer de mama - Obesidad - Composición corporal.
Introducción
La obesidad, definida como un índice de masa corporal (IMC) de 30 kg/m2 o más, es un factor de riesgo para el desarrollo de cáncer de mama con receptor de estrógeno (RE) positivo en mujeres posmenopáusicas (1, 2). Después del diagnóstico de cáncer de mama, la obesidad se asocia con un mayor riesgo de recaída y una disminución de la supervivencia general en todos los subtipos de tumores de mama (3–6). Un estado inflamatorio en el tejido adiposo mamario (WAT, por sus siglas en inglés) que ocurre en la mayoría de las mujeres con IMC elevado, está asociado con niveles elevados de aromatasa, la enzima limitante de la biosíntesis de estrógenos (7–10). La aromatasa es un objetivo farmacológico clave tanto para la prevención como para el tratamiento del cáncer de mama, y se cree que su expresión local en el WAT de mama impulsa el crecimiento de tumores en mujeres posmenopáusicas. Hay información que la inflamación del WAT de la mama se asocia con un peor pronóstico para las pacientes con cáncer de mama, incluido un tiempo más corto hasta la recurrencia y una peor supervivencia general (10-12).
Se ha implicado a la inflamación en la patogenia de los trastornos asociados con la obesidad que promueven el crecimiento del cáncer de mama (13–21). Estos incluyen la resistencia a la insulina y otras condiciones agrupadas como síndrome metabólico, por ejemplo, hipertensión, dislipidemia e hiperglucemia en ayunas (22). Se han llevado a cabo varios ensayos clínicos relacionados con el equilibrio energético, es decir, la modificación de la dieta y/o la actividad física, o la orientación farmacológica de las vías metabólicas que comúnmente están desreguladas en el contexto de un IMC elevado, para atenuar los efectos de la obesidad en el riesgo de cáncer y mortalidad (23–30).
Actualmente, el IMC es la medida de obesidad más utilizada en los ensayos clínicos que tienen como objetivo mitigar su impacto negativo en el riesgo y la progresión del cáncer. Sin embargo, se ha informado que los trastornos del síndrome metabólico que se asocian clásicamente con un IMC elevado ocurren en un subconjunto de personas con un IMC normal (31, 32). Cuando se encuentran en individuos con un IMC normal, estos trastornos se denominan colecti cardiometabólica y el riesgo de enfermedades cardiometabólicas cuando se utiliza el IMC (35). También es probable que ocurra lo mismo al evaluar el riesgo de cáncer (9).
El IMC no describe la composición corporal, ya que no puede distinguir el tejido magro del graso. Por lo tanto, aunque hay evidencia significativa de que un IMC alto se asocia con un mayor riesgo de cáncer de mama en mujeres posmenopáusicas y con peores resultados clínicos en todas las edades, la naturaleza exacta de la exposición sigue siendo incierta. Esta incertidumbre se refleja en la gama de diferentes enfoques adoptados para caracterizar o describir la composición corporal en la literatura: IMC, peso corporal, composición corporal, estado metabólico y estado nutricional. La mayoría de los estudios han utilizado la medida relativamente simple del IMC. Dada la importancia de este factor de riesgo, no solo por influir en la incidencia de cáncer de mama, sino también por su asociación con peores resultados clínicos después del diagnóstico, es crucial caracterizar con mayor precisión los aspectos de la composición corporal o los factores metabólicos o fisiológicos asociados.
Aunque la asociación entre el IMC y el riesgo y la recurrencia del cáncer de mama se ha estudiado ampliamente, la composición corporal (masa grasa y magra) se reconoce como un indicador de mal pronóstico que estimula la progresión del cáncer a través de la inflamación crónica del tejido adiposo blanco mamario (36). Los sobrevivientes al cáncer de mama tienen una prevalencia de obesidad de 2 a 3 veces mayor que los sobrevivientes de otros cánceres (es decir, cáncer de riñón, páncreas y tiroides), y se estima que la obesidad causará > 500000 casos adicionales de cáncer en los Estados Unidos para 2030 (37).
La composición corporal ha sido medida por una variedad de métodos, incluyendo absorciometría de rayos X de energía dual (DXA) (38), tomografía computarizada (39), análisis de impedancia bioeléctrica (BIA) (40), pliegues cutáneos (41), e imágenes de resonancia magnética (42) para describir y reducir los componentes corporales excesivos (es decir, adiposidad central, masa de grasa corporal) que se sabe que están relacionados con un mayor riesgo de mortalidad y recurrencia por cáncer de mama. Cada procedimiento tiene distintas ventajas y desventajas, en cuanto a precisión, factibilidad, costo y disponibilidad; sin embargo, algunos procedimientos pueden estar limitados para las investigaciones debido a la disponibilidad y el costo, y pueden contribuir a que los resultados de los estudios clínicos no sean confiables (43-48).
Aparte de los síndromes de línea germinal hereditarios conocidos, la etiología del cáncer de mama en individuos con IMC normal no se conoce bien. Presumimos que un estado metabólicamente obeso podría contribuir al cáncer de mama a pesar de un IMC normal. Ademas, la relación entre el IMC y la masa magra o grasa puede diferir entre personas con o sin enfermedad. Por lo tanto, surge la pregunta de cómo se asocian la obesidad metabólica, el PGC y el IMC en pacientes con cáncer de mama. Esta pregunta no se aborda en la literatura. La mayoría de los estudios han utilizado solo el IMC, sin discutir sus deficiencias como marcador de la composición corporal, lo que lleva a una interpretación errónea potencialmente importante. De esta forma, el impacto de la obesidad en la salud pública sobre el riesgo de cáncer y la mortalidad puede ser mucho mayor de lo previsto originalmente por las categorías de IMC convencionales. Entonces es importante identificar la asociación observada entre el IMC, la obesidad metabólica y el PGC para mejorar el resultado clínico de la evaluación y reducir el impacto de la obesidad en la salud pública sobre el riesgo de cáncer y la mortalidad.
Investigamos las diferentes medidas de obesidad: por IMC, la metabólica y por el porcentaje de grasa corporal y cómo se relacionan entre si al diagnóstico de cáncer de mama.
Objetivos
El objetivo principal fue determinar la correlación entre las diferentes definiciones de obesidad: la obesidad por IMC (OB IMC), la obesidad metabólica (OB MTB) y la obesidad por el porcentaje de grasa corporal (OB PGC) en mujeres con cáncer de mama y su correlación. Los objetivos secundarios incluyeron analizar la obesidad según las características moleculares y pronósticas del cáncer de mama.
Material y Método
Fueron elegibles las mujeres con diagnóstico de cáncer de mama en la Secretaria de Salud de la Municipalidad de Rosario durante el 2023. Estudio retrospectivo, descriptivo y transversal. El IMC se consideró según los criterios de la Organización Mundial de la Salud (OMS) dividiendo peso en kilogramos por el cuadrado de la estatura en metros (IMC = peso (kg)/ [estatura (m)]2) (49). Según la OMS se consideró normopeso un IMC ≥18,5 y <25 kg/m2, el sobrepeso se definió como un IMC ≥ 25 kg/m2 y se consideró que una persona es obesa si su IMC era ≥ a 30 kg/m2. Para las medi ciones del porcentaje de grasa corporal seguimos el protocolo ISAK, un estándar internacional que asegura la comparabilidad de los resultados entre diferentes individuos y estudios (50). Medimos la circunferencia de la cintura en cm. Todas estas mediciones se registraron el día del diagnóstico, en consultorio, al arribo del informe anatomopatológico. La puntuación total reflejó la evaluación de la composición corporal. El porcentaje de grasa corporal (PGC) se consideró aceptable en mujer no atleta 25 a 31% y obesidad ≥32%.
Para realizar las medidas antropométricas, se emplearon varios instrumentos correctamente calibrados para estas mediciones: una balanza, un tallímetro, un plicómetro, una cinta métrica y un calibre de grandes diámetros. El protocolo ISAK define puntos anatómicos específicos en el cuerpo humano que sirven como referencia para realizar las mediciones, puntos fácilmente identificables y reproducibles entre diferentes observadores. Tomamos todas las medidas y las registraremos, cada medida se tomó al menos dos veces. En caso de diferencia mayor al 5% en los pliegues o del 1% en las demás medidas entre las dos tomas, repetimos la medición una tercera vez. En caso de haber realizado dos mediciones, utilizamos la media; si tomamos tres, utilizamos la mediana. Si la paciente presenta obesidad o edemas, se registraron como observaciones, ya que este método no se recomienda en tales casos debido a posibles sesgos o complicaciones para efectuar las mediciones.
Todas las pacientes firmaron el Consentimiento Informado luego de una detallada explicación en presencia de tercera persona. Los pacientes con mutaciones BRCA conocidas o embarazadas no fueron elegibles. En el momento de la cirugía, se recogieron prospectivamente muestras de sangre en ayunas. Este estudio fue aprobado por el comité de docencia e investigación y comité de ética de la entidad participante.
Los datos clinicopatológicos se extrajeron de la historia clínica (HC). El estado menopáusico se clasificó como premenopáusico o posmenopáusico. Los diagnósticos de comorbilidades como diabetes, hipertensión y dislipidemia se registraron si el médico tratante los documentara en la HC. El subtipo de tumor se clasificó como ER y/o receptor de progesterona (PR) positivo si se informa >1% de tinción por inmunohistoquímica (IHC). El receptor 2 del factor de crecimiento epidérmico humano (HER2) se clasificó como positivo o negativo si IHC 3+ o amplificación FISH ≥ 2,0 (51).
El cáncer de mama fue estadificado utilizando el sistema TNM de la 8a edición del AJCC (Comité del Cáncer Estadounidense) basado en factores anatómicos y pronósticos (51). Factores anatómicos: la extensión del tumor primario (T), la diseminación a los ganglios linfáticos regionales (N) y la presencia de metástasis a distancia (M). Incorporando los factores pronósticos que incluyen grado histológico, ER, PR y HER2.
Para cada sujeto, se obtendrá una muestra de sangre en ayunas de 30 ml antes de la operación el día de la cirugía. La sangre se separó en suero y plasma mediante centrifugación dentro de las 3 horas posteriores a la recolección y se almacenó a -80º C. Los niveles de glucosa, los lípidos séricos, incluidos el colesterol total, las lipoproteínas de alta densidad (HDL) y las lipoproteínas de baja densidad (LDL), y los triglicéridos, se midieron en el laboratorio de bioquímica. Los coeficientes de variación intraensayo para las muestras de control de calidad fueron inferiores al 7 %. Las asociaciones se analizaron utilizando la Prueba U de Mann-Whitney para muestras independientes, la significación estadística se fijó en P < 0,05.
Resultados
Las características de la población se resumen en la tabla 1.
Tabla 1 - Características clínicas y tumorales de la población.
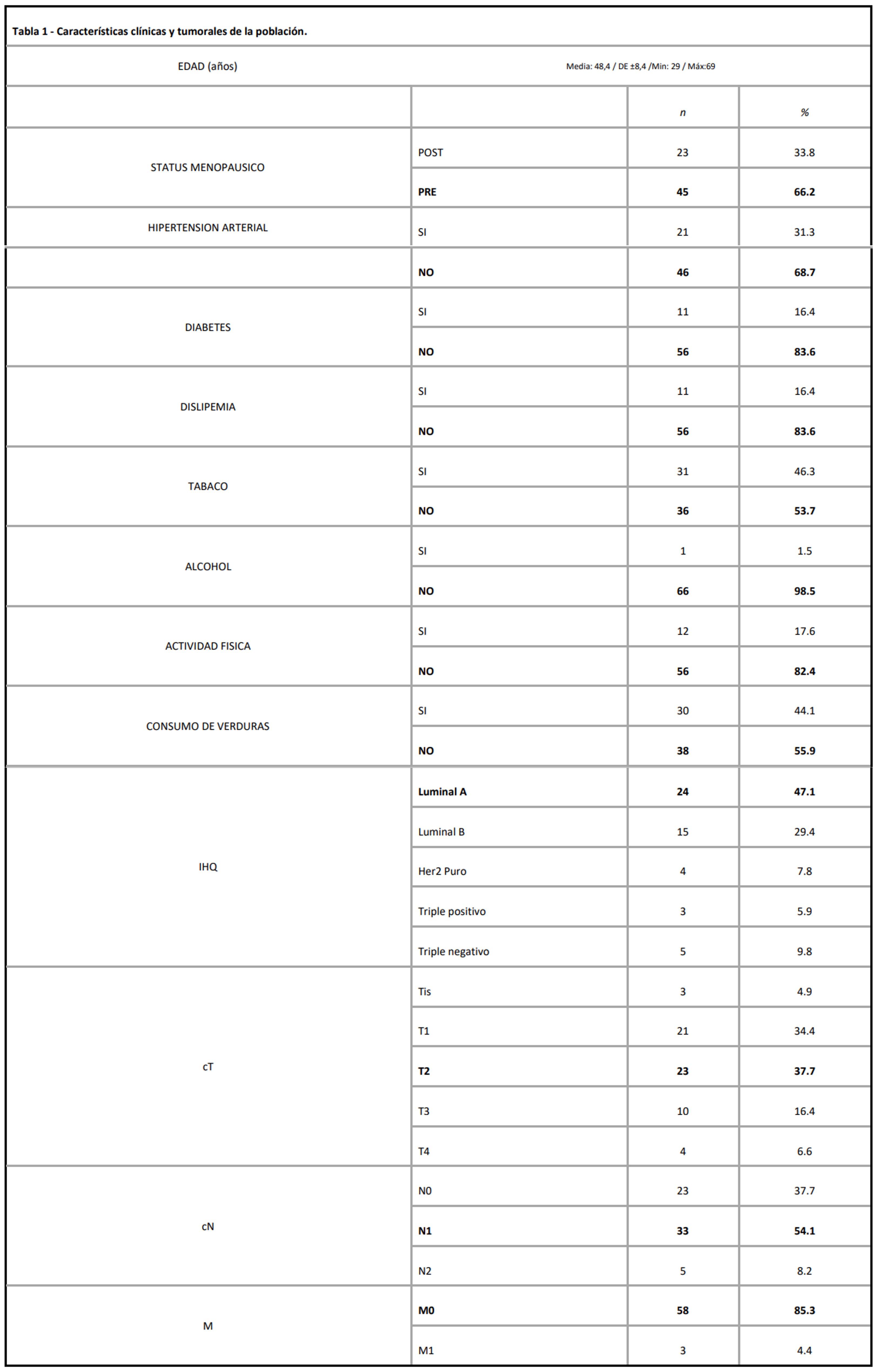
Inferimos que el IMC, el PGC y el estado MTB no miden la obesidad de la misma manera (p < 0,0001). El IMC ha sido la forma más común de caracterizar la grasa corporal. Sin embargo, no distingue entre componentes de la composición corporal y no describe la distribución de la grasa. Nuestros resultados concuerdan con que la medición del PGC podría ser más predictivo de OB que el IMC como factor de riesgo. En tabla 2 se resumen los casos de obesidad según las distintas mediciones. Tabla 2 - Clasificación de obesidad según IMC, estado metabólico y porcentaje de grasa corporal.
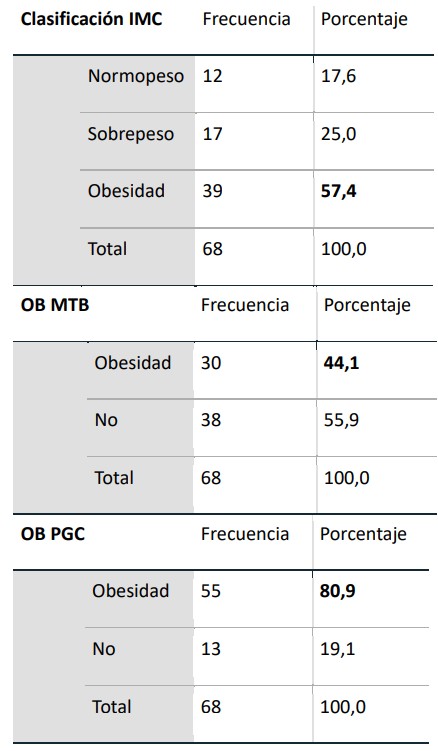
Mediante la Prueba U de Mann-Whitney para muestras independientes se infiere que IMC y OB MTB no miden de la misma manera a la obesidad (p < 0,0001) y que OB PGC y OB MTB no miden a la obesidad de la misma manera (p< 0,0001). Gráfico 1.
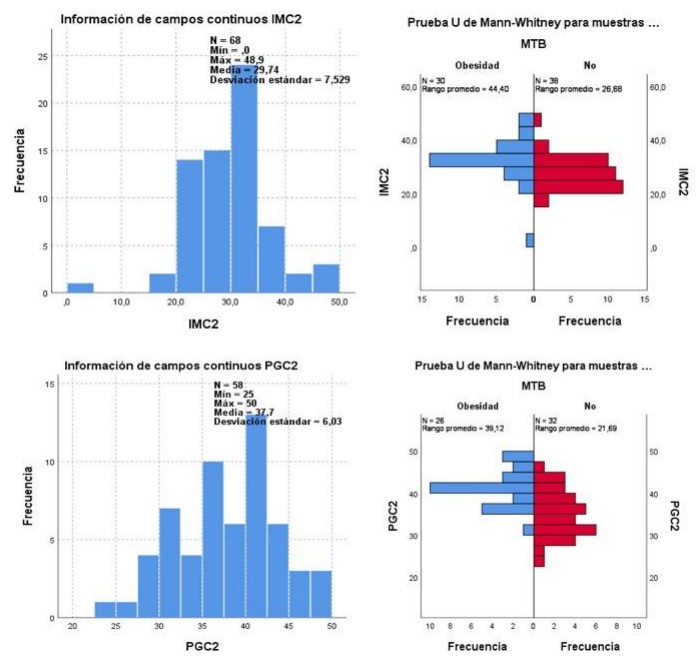
Gráfico 1
Discusión
Existe evidencia científica de vínculo causal entre la obesidad y varios tipos de cáncer, entre ellos se destacan el adenocarcinoma de esófago y los cánceres de colon, recto, riñón, páncreas, vesícula biliar, mama posmenopáusica, cuerpo del útero y ovario. Utilizando el índice de masa corporal (IMC) como indicador del estado nutricional de las personas, obtenido a partir de la altura y el peso de los individuos y considerando como obesidad un IMC igual o mayor a 30, la IARC estimó la proporción de casos de cáncer atribuibles a este factor (52).
Según las estimaciones realizadas por el Observatorio Global del Cáncer (Globocan), de la Agencia Internacional de Investigación sobre Cáncer (IARC, por sus siglas en inglés), realizadas en el año 2012, el 6,8% (7.600 casos) de todos los casos de cáncer de nuestro país se atribuyeron al factor obesidad, lo cual posicionó a nuestro país en el nivel más alto de este indicador a nivel mundial (52). Si bien al momento no existen datos actualizados, según la 4ª Encuesta Nacional de Factores de Riesgo (53), la prevalencia de exceso de peso (sobrepeso + obesidad) en nuestro país, lejos de ser un problema controlado, muestra valores en aumento. La prevalencia en adultos para el año 2013 alcanzó al 57,9% de la población, llegando al 61,6% en el año 2018, con lo cual, si esta tendencia persiste, es probable que los casos de cáncer atribuibles a este factor sean aún mayores. Se observó que la prevalencia de obesidad aumentó significativamente en cada una de las ediciones, siendo mayor a menor nivel de instrucción y a menor nivel de ingresos (no observándose diferencias significativas según sexo y cobertura de salud). Estos resultados advierten también que Santa Fe se encuentran entre las siete provincias con mayor prevalencia de obesidad.
Nosotros tuvimos mas del 57 % de la población obesa por IMC y el 81% por PGC. Siendo el 82% sedentarias y el 56% no consume verduras y frutas al menos una vez al día. El cáncer de mama representa un problema de salud pública a nivel mundial. En Argentina, el cáncer de mama es el de mayor magnitud en cuanto a ocurrencia: con un volumen de más de 22.024 casos al año, representa el 16,8% de todos los tumores malignos y casi un tercio de los cánceres femeninos (32,1%) (52).
Muchos estudios han indicado que, en mujeres posmenopáusicas, un IMC más elevado se asocia con un ligero aumento del riesgo de cáncer de mama. Un aumento de 5 unidades en el IMC está asociado con un aumento de 12 % en el riesgo (53). En mujeres posmenopáusicas, quienes son obesas tienen de 20 a 40 % de aumento en el riesgo de presentar cáncer de seno en comparación con mujeres de peso normal (54). Los riesgos mayores se observan principalmente en las mujeres que nunca han usado la terapia hormonal para la menopausia y para tumores que expresan receptores hormonales. La obesidad es también un factor de riesgo para cáncer de seno en los hombres (55). En mujeres premenopáusicas, por el contrario, se ha indicado que el sobrepeso y la obesidad están asociados con una disminución de 20 % del riesgo de tumores de seno que expresan receptores hormonales (54).
Nuestra población es mayormente joven, el 66% fueron premenopáusicas. El 76,5% fueron tumores hormonosensibles y solo el 34,4% debutó con ganglios axilares negativos. El estado ganglionar es uno de los factores pronósticos mas importantes en cáncer de mama y en nuestra serie mas de la mitad se diagnosticaron con axila positiva.
Después del diagnóstico de cáncer de mama, la obesidad se asocia con un mayor riesgo de recaída y una disminución de la supervivencia general en todos los subtipos de tumores de mama (3–6). Un estado inflamatorio que ocurre en la mayoría de las mujeres con IMC elevado, está asociado con niveles elevados de aromatasa, la enzima limitante de la biosíntesis de estrógenos (7–10). La aromatasa es un objetivo farmacológico clave tanto para la prevención como para el tratamiento del cáncer de mama, y se cree que su expresión local en el WAT de mama impulsa el crecimiento de tumores en mujeres posmenopáusicas. Hay información que la inflamación del WAT de la mama se asocia con un peor pronóstico para las pacientes con cáncer de mama, incluido un tiempo más corto hasta la recurrencia y una peor supervivencia general (10, 11). La existencia de inflamación WAT mamaria en mujeres libres de cáncer sugiere que su presencia también podría contribuir al desarrollo del cáncer (12).
Se ha implicado a la inflamación en la patogenia de los trastornos asociados con la obesidad que promueven el crecimiento del cáncer de mama (13–21). Estos incluyen la resistencia a la insulina y otras condiciones agrupadas como síndrome metabólico, por ejemplo, hipertensión, dislipidemia e hiperglucemia en ayunas (22).
En discordancia con la ultima encuesta nacional sobre factores de riesgo obtuvimos un alto porcentaje de mujeres fumadoras (46%), sin diferencias significativas en porcentajes de hipertensos y diabéticos (53).
Se han llevado a cabo varios ensayos clínicos relacionados con el equilibrio energético, es decir, la modificación de la dieta y/o la actividad física, o la orientación farmacológica de las vías metabólicas que comúnmente están desreguladas en el contexto de un IMC elevado, para atenuar los efectos de la obesidad en el riesgo de cáncer y mortalidad (23–30).
Los pacientes oncológicos se someten a un proceso de tratamiento dinámico y su estado nutricional a menudo puede variar. Hoy en día, el cáncer de mama se encuentra entre los cánceres con mayor tasa de supervivencia. El número de pacientes en proceso de seguimiento aumenta exponencialmente con el aumento de las herramientas de diagnóstico y la esperanza de vida. Los estudios de cambios en el estilo de vida están ganando importancia para mejorar la calidad de vida y las tasas de supervivencia de los pacientes con cáncer de mama. La evaluación de la composición corporal a menudo está involucrada en el alcance y el enfoque de estos estudios en cuestión. El BIA, que es un método de medición no invasivo, de fácil acceso, económico y frecuentemente repetible con respecto a la evaluación de la composición corporal (46,47). La monitorización estrecha de las composiciones corporales de pacientes con cáncer de mama junto con el tratamiento adyuvante, y la planificación y monitorización individual de las recomendaciones de nutrición y actividad física según los resultados del BIA pueden aumentar el éxito del seguimiento. En nuestro ámbito público no tenemos disponible la aparatologia para BIA recomendada ni la resonancia corporal total, por lo cual utilizamos la antropometría conjuntamente con el servicio de nutrición para la validez de los resultados.
Actualmente, el IMC es la medida de obesidad más utilizada en los ensayos clínicos que tienen como objetivo mitigar su impacto negativo en el riesgo y la progresión del cáncer. Sin embargo, se ha informado que los trastornos del síndrome metabólico que se asocian clásicamente con un IMC elevado ocurren en un subconjunto de personas con un IMC normal (31, 32). Cuando se encuentran en individuos con un IMC normal, estos trastornos se denominan colecti
cardiometabólica y el riesgo de enfermedades cardiometabólicas cuando se utilizan categorías de IMC (35,56). Teniendo en cuenta que la inflamación WAT de la mama también se encuentra en un subconjunto de mujeres con un IMC normal (9), es probable que ocurra lo mismo al evaluar el riesgo de cáncer. Por lo tanto, el impacto de la obesidad en la salud pública sobre el riesgo de cáncer y la mortalidad puede ser mucho mayor de lo previsto originalmente por las categorías de IMC convencionales.
Nuestros resultados reflejan que el IMC, el PGC y el síndrome MTB no miden la OBESIDAD de la misma manera. El IMC podría subestimar la obesidad. La OB PGC podría ser una causa contribuyente del cáncer de mama independientemente del IMC y en consecuencia, nuestros hallazgos son de suma importancia para identificar personas vulnerables y plantear abordajes más oportunos.
La valoración de la composición corporal, que forma parte de la evaluación del estado nutricional, va a adquirir un protagonismo creciente en los próximos años, favorecido por diversas situaciones sociosanitarias (57-59) siendo las más relevantes por su impacto en la atención diaria el aumento de personas mayores de 65 años, el aumento de personas con sobrepeso, obesidad y el papel de la nutrición y del estado nutricional en la morbimortalidad por múltiples procesos crónicos a cualquier edad.
Durante el tratamiento y el seguimiento del cáncer de mama, se recomienda monitorear cuidadosamente los cambios en la composición corporal del paciente y disuadir los cambios necesarios en el estilo de vida del paciente. Además del tratamiento oncológico, se sabe que la evaluación y el seguimiento del estado nutricional es de una buena práctica clínica en oncología (60-65). La evaluación de la composición corporal otorga conocimiento tanto del estado nutricional como de la capacidad funcional del ser humano, también se utiliza para evaluar los resultados de las intervenciones de tratamiento, diseñar estrategias de nutrición, realizar evaluaciones relacionadas con la enfermedad y la salud, e identificar el crecimiento y el desarrollo en todas las edades (66-68).
Nuestros resultados podrían ser generalizables a otras áreas de salud de características similares y útiles a la hora de planificar estrategias dirigidas a actividades de prevención tendientes a disminuir la obesidad de las mujeres. Como consecuencia, estos hallazgos podrían ser de interés tanto para el personal sanitario como para quienes gestionan las instituciones sanitarias y pretendan optimizar los recursos preventivos vigentes que se fundamentan en evidencias científicas, como es el caso de los tumores obesidad relacionables.
Conclusión
Este estudio resalta la necesidad de reconsiderar cómo se mide la obesidad en el contexto del cáncer de mama. Los datos obtenidos indican que el IMC, PGC y MTB no proporcionan una evaluación homogénea de la obesidad, lo que puede llevar a una subestimación del verdadero riesgo asociado. Específicamente, el PGC ha demostrado ser un factor contribuyente significativo al desarrollo del cáncer de mama, más allá de lo que el IMC puede reflejar.
La obesidad, que se relaciona con un mayor riesgo y peores resultados clínicos en pacientes con cáncer de mama, requiere una caracterización más precisa en la práctica clínica y en la investigación. Esta labor no solo permitirá identificar a las personas en mayor riesgo, sino que también podrá guiar el diseño e implementación de estrategias de intervención más efectivas. Incorporar que evalúen mejor composición la corporal y el estado metabólico es fundamental para abordar el impacto de la obesidad en los sistemas de salud y para optimizar los resultados en pacientes oncológicos.
Bibliografía
- Trentham-Dietz A, Newcomb PA, Storer BE, Longnecker MP, Baron J, Greenberg ER, et al. Body size and risk of breast cancer. Am J Epidemiol 1997;145:1011–9.
- Iyengar NM, Hudis CA, Dannenberg AJ. Obesity and cancer: local and systemic mechanisms. Annu Rev Med 2015;66:297–309.
- Calle EE, Rodriguez C, Walker-Thurmond K, Thun MJ. Overweight, obesity, and mortality from cancer in a prospectively studied cohort of U.S. adults. N Engl J Med 2003;348:1625–38.
- Ewertz M, Jensen MB, Gunnarsdottir KA, Hojris I, Jakobsen EH, Nielsen D, et al. Effect of obesity on prognosis after early-stage breast cancer. J Clin Oncol 2011;29:25–31.
- Protani M, Coory M, Martin JH. Effect of obesity on survival of women with breast cancer: systematic review and meta-analysis. Breast Cancer Res Treat 2010;2010:23.
- Sparano JA, Zhao F, Martino S, Ligibel JA, Perez EA, Saphner T, et al. Long- term follow-up of the E1199 phase III trial evaluating the role of taxane and schedule in operable breast cancer. J Clin Oncol 2015;33:2353–60. 7. Morris PG, Hudis CA, Giri D, Morrow M, Falcone DJ, Zhou XK, et al. Inflammation and increased aromatase expression occur in the breast tissue of obese women with breast cancer. Cancer Prev Res (Phila) 2011;4:1021–9.
- Subbaramaiah K, Morris PG, Zhou XK, Morrow M, Du B, Giri D, et al. Increased levels of COX-2 and prostaglandin E2 contribute to elevated aromatase expression in inflamed breast tissue of obese women. Cancer Discov 2012;2:356–65.
- Iyengar NM, Morris PG, Zhou XK, Gucalp A, Giri D, Harbus MD, et al. Menopause is a determinant of breast adipose inflammation. Cancer Prev Res (Phila) 2015;8:349–58.
- Iyengar NM, Zhou XK, Gucalp A, Morris PG, Howe LR, Giri DD, et al. Systemic correlates of white adipose tissue inflammation in early-stage breast cancer. Clin Cancer Res 2016;22:2283–9.
- Koru-Sengul T, Santander AM, Miao F, Sanchez LG, Jorda M, Gluck S, et al. Breast cancers from black women exhibit higher numbers of immunosup- pressive macrophages with proliferative activity and of crown-like struc- tures associated with lower survival compared to non-black Latinas and Caucasians. Breast Cancer Res Treat 2016;158:113–26.
- Sun X, Casbas-Hernandez P, Bigelow C, Makowski L, Joseph Jerry D, Smith Schneider S, et al. Normal breast tissue of obese women is enriched for macrophage markers and macrophage-associated gene expression. Breast Cancer Res Treat 2012;131:1003– 12.
- Olefsky JM, Glass CK. Macrophages, inflammation, and insulin resistance. Annu Rev Physiol 2010;72:219–46.
- Rosen ED, Spiegelman BM. What we talk about when we talk about fat. Cell 2014;156:20–44.
- Monteiro R, Azevedo I. Chronic inflammation in obesity and the metabolic syndrome. Mediators Inflamm 2010;2010. pii: 289645.
- Berrino F, Villarini A, Traina A, Bonanni B, Panico S, Mano MP, et al. Metabolic syndrome and breast cancer prognosis. Breast Cancer Res Treat 2014;147:159–65.
- Goodwin PJ, Ennis M, Pritchard KI, Trudeau ME, Koo J, Madarnas Y, et al. Fasting insulin and outcome in early-stage breast cancer: results of a prospective cohort study. J Clin Oncol 2002;20:42–51.
- Duggan C, Irwin ML, Xiao L, Henderson KD, Smith AW, Baumgartner RN, et al. Associations of insulin resistance and adiponectin with mortality in women with breast cancer. J Clin Oncol 2011;29:32–9.
- Gunter MJ, Wang T, Cushman M, Xue X, Wassertheil-Smoller S, Strickler HD, et al. Circulating adipokines and inflammatory markers and post- menopausal breast cancer risk. J Natl Cancer Inst 2015;107. pii: djv169.
- Gunter MJ, Xie X, Xue X, Kabat GC, Rohan TE, Wassertheil-Smoller S, et al. Breast cancer risk in metabolically healthy but overweight postmenopausal women. Cancer Res 2015;75:270–4.
- Erickson K, Patterson RE, Flatt SW, Natarajan L, Parker BA, Heath DD, et al. Clinically defined type 2 diabetes mellitus and prognosis in early-stage breast cancer. J Clin Oncol 2011;29:54–60.
- Alberti KG, Eckel RH, Grundy SM, Zimmet PZ, Cleeman JI, Donato KA, et al. Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes federation task force on epidemiology and prevention; national heart, lung, and blood institute; american heart association; world heart federation; international atherosclerosis society; and international association for the study of obesity. Circulation 2009;120:1640–5.
- Campbell KL, Foster-Schubert KE, Alfano CM, Wang CC, Wang CY, Duggan CR, et al. Reduced-calorie dietary weight loss, exercise, and sex hormones in postmenopausal women: randomized controlled trial. J Clin Oncol 2012;30:2314–26.
- Demark-Wahnefried W, Morey MC, Sloane R, Snyder DC, Miller PE, Hartman TJ, et al. Reach out to enhance wellness homebased diet-exercise intervention promotes reproducible and sustainable long-term improve- ments in health behaviors, body weight, and physical functioning in older, overweight/obese cancer survivors. J Clin Oncol 2012;30:2354–61.
- Chlebowski RT, Blackburn GL, Thomson CA, Nixon DW, Shapiro A, Hoy MK, et al. Dietary fat reduction and breast cancer outcome: interim efficacy results from the Women's Intervention Nutrition Study. J Natl Cancer Inst 2006;98:1767–76.
- Pierce JP, Natarajan L, Caan BJ, Parker BA, Greenberg ER, Flatt SW, et al. Influence of a diet very high in vegetables, fruit, and fiber and low in fat on prognosis following treatment for breast cancer: the Women's Healthy Eating and Living (WHEL) randomized trial. JAMA 2007;298:289–98.
- Garwood ER, Kumar AS, Baehner FL, Moore DH, Au A, Hylton N, et al. Fluvastatin reduces proliferation and increases apoptosis in women with high grade breast cancer. Breast Cancer Res Treat 2010;119:137–44.
- Higgins MJ, Prowell TM, Blackford AL, Byrne C, Khouri NF, Slater SA, et al. A short-term biomarker modulation study of simvastatin in women at increased risk of a new breast cancer. Breast Cancer Res Treat 2012;131: 915–24. 29. Jiralerspong S, Palla SL, Giordano SH, Meric-Bernstam F, Liedtke C, Barnett CM, et al. Metformin and pathologic complete responses to neoadjuvant chemotherapy in diabetic patients with breast cancer. J Clin Oncol 2009;27:3297–302.
- Goodwin PJ, Parulekar WR, Gelmon KA, Shepherd LE, Ligibel JA, Hersh- man DL, et al. Effect of metformin vs placebo on weight and metabolic factors in NCIC CTG MA.32. J Natl Cancer Inst 2015;107. pii: djv006.
- Chen S, Chen Y, Liu X, Li M, Wu B, Li Y, et al. Insulin resistance and metabolic syndrome in normal-weight individuals. Endocrine 2014;46: 496–504.
- Deepa M, Papita M, Nazir A, Anjana RM, Ali MK, Narayan KM, et al. Lean people with dysglycemia have a worse metabolic profile than centrally obese people without dysglycemia. Diabetes Technol Ther 2014;16:91–6.
- Ruderman N, Chisholm D, Pi-Sunyer X, Schneider S. The metabolically obese, normal-weight individual revisited. Diabetes 1998;47:699–713.
- St-Onge MP, Janssen I, Heymsfield SB. Metabolic syndrome in normal- weight Americans: new definition of the metabolically obese, normal- weight individual. Diabetes Care 2004;27:2222–8.
- Tomiyama AJ, Hunger JM, Nguyen-Cuu J, Wells C. Misclassification of cardiometabolic health when using body mass index categories in NHANES 2005–2012. Int J Obes (Lond) 2016;40:883–6.
- Dieli-Conwright CM, Parmentier JH, Sami N, et al. Adipose tissue inflammation in breast cancer survivors: effects of a 16-week combined aerobic and resistance exercise training intervention. Breast Cancer Res Treatment. 2017;168(1):147-157.
- Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015. CA: Cancer J Clinicians 2015; 65(1):5-29.
- Czerniec SA, Ward LC, Meerkin JD, Kilbreath SL. Assessment of segmental arm soft tissue composition in breast cancer-related lym- phedema: a pilot study using dual energy x-ray absorptiometry and bioimpedance spectroscopy. Lymphat Res Biol. 2015;13(1):33-39.
- Deluche E, Leobon S, Desport JC, Venat-Bouvet L, Usseglio J, Tubiana-Mathieu N. Impact of body composition on outcome in patients with early breast cancer. Supportive Care Cancer 2017;26(3): 861-868.
- Barrio AV, Eaton A, Frazier TG. A prospective validation study of bioimpedance with volume displacement in early-stage breast cancer patients at risk for lymphedema. Ann Surg Oncol. 2015;22: S370-S375.
- Roberts CC, Levick JR, Stanton AW, Mortimer PS. Assessment of truncal edema following breast cancer treatment using modified Harpenden skinfold calipers. Lymphol. 1995;28(2):78-88.
- Riedl CC, Luft N, Bernhart C, et al. Triple-modality screening trial for familial breast cancer underlines the importance of magnetic resonance imaging and questions the role of mammography and ultrasound regardless of patient mutation status, age, and breast density. J Clin Oncol. 2015;33(10):1128-1134.
- Trevino-Aguirre E, Lopez-Teros T, Gutierrez-Robledo L, Vandewoude M, Perez-Zepeda M. Availability and use of dual energy x-ray absorp- tiometry (DXA) and bio-impedance analysis (BIA) for the evaluation of sarcopenia by Belgian and Latin American geriatricians. J Cachexia Sarcopeni. 2014;5(1):79-81.
- Popovic V, Zerahn B, Heaf J. Validity of dual energy x-ray absorp- tiometry and bioimpedance in assessing body composition and nutri- tion in peritoneal dialysis patients. Nephrol Dial Transpl. 2015;30(3): 537-555.
- Glickman SG, Marn CS, Supiano MA, Dengel DR. Validity and reliability of dual-energy x-ray absorptiometry for the assessment of abdominal adiposity. J Appl Physiol. 2004; 97(2):509-514.
- Wells JCK, Williams JE, Fewtrell M, Singhal A, Lucas A, Cole TJ. A simplified approach to analysing bio-electrical impedance data in epidemiological surveys. Int J Obesity 2007;31(3):507-514.
- Akyol M, Demir L, Alacacioglu A, et al. The effects of adjuvant endocrine treatment on the serum leptin, adiponectin and body com- position in patients with breast cancer (Izmir Oncology Group [IZOG] Study). Eur J Cancer 2015;51:S317.
- Volgyi E, Tylavsky FA, Lyytikainen A, Suominen H, Alen M, Cheng SL. Assessing body composition with DXA and bioimpedance: effects of obesity, physical activity, and age. Obes 2008;16(3): 700-705.
- WHO. Obesity: preventing and managing the global epidemic. Report of a WHO Consultation WHO Technical Report Series 894, World Health Organization, Geneva (2000). 50. Esparza-Ros F, Vaquero-Cristóbal R, Marfell-Jones M. Protocolo internacional para la valoración antropométrica. Sociedad Internacional para el Avance de la Cineantropometría (2019). https://books.google.com.ar/books?id=eRqfzgEACAAJ.
- Wolff AC, Hammond ME, Hicks DG, Dowsett M, McShane LM, Allison KH, et al. Recommendations for human epidermal growth factor receptor 2 testing in breast cancer: American Society of Clinical Oncology/College of American Pathologists clinical practice guideline update. J Clin Oncol 2013;31:3997–4013.
- https://www.argentina.gob.ar/salud/instituto-nacional-del-cancer/estadisticas/incidencia. Último acceso: 20 de febrero de 2023.
- Ministerio de Salud y Desarrollo Social de la Nación. (2019b). 4° Encuesta Nacional de Factores de Riesgo: informe definitivo. Argentina. https://bancos.salud.gob.ar/sites/default/files/2020-01/4ta-encuesta-nacional-factores-riesgo_2019_informe-definitivo.pdf. Último acceso: 20 de febrero de 2023.
- Renehan AG, Tyson M, Egger M, Heller RF, Zwahlen M. Body-mass index and incidence of cancer: a systematic review and meta-analysis of prospective observational studies. Lancet 2008; 371(9612):569-578.
- Munsell MF, Sprague BL, Berry DA, Chisholm G, Trentham-Dietz A. Body mass index and breast cancer risk according to postmenopausal estrogen-progestin use and hormone receptor status. Epidemiologic Reviews 2014; 36:114-136.
- Brinton LA, Cook MB, McCormack V, et al. Anthropometric and hormonal risk factors for male breast cancer: male breast cancer pooling project results. Journal of the National Cancer Institute 2014; 106(3):djt465
- Amin MB, Greene FL, Edge SB, et al. The Eighth Edition AJCC Cancer Staging Manual: Continuing to build a bridge from a population-based to a more “personalized” approach to cancer staging. CA Cancer J Clin. 2017;67(2):93–99. 1072.
- Martínez Valls JF. Diagnóstico y valoración del estado nutricional. Medicine 7.a serie, 1999; 110: 5125-5135.
- Espinosa Almendro JM. El anciano en atención primaria. Aten Primaria 2000; 26: 515-516.
- Union for International Cancer Control. GLOBOCAN 2020: New Global Cancer Data. 2020. https://gco.iarc.fr/today/data/factsheets/populations/900- world-fact-sheets.pdf. Último acceso: 20 de febrero de 2023.
- World Cancer Research Fund International. Diet, Nutrition, Physical Activity and Breast Cancer. Continuous Update Project Expert Report 2018. World Cancer Research Fund Interna- tional; 2018.
- Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer. 2015;136(5):E359‐E386.
- Kolb R, Phan L, Borcherding N, et al. Obesity‐associated NLRC4 inflammasome activation drives breast cancer progression. Nat Commun. 2016;7:13007.
- Norman K, Stobäus N, Zocher D, et al. Cutoff percentiles of bioelectrical phase angle predict functionality, quality of life, and mortality in patients with cancer. Am J Clin Nutr. 2010;92(3):612‐619.
- Massy‐Westropp NM, Gill TK, Taylor AW, Bohannon RW, Hill CL. Hand grip strength: age and gender stratified normative data in a population‐based study. BMC Res Notes. 2011;4(1):127.
- Kuriyan R. Body composition techniques. Indian J Med Res. 2018;148(5):648‐658.
- Thibault R, Genton L, Pichard C. Body composition: why, when and for who? Clin Nutr. 2012;31(4):435‐447.
- Andreoli A, Garaci F, Cafarelli FP, Guglielmi G. Body composition in clinical practice. Eur J Radiol. 2016;85(8): 1461‐1468.
1. Secretaria de Salud Pública de la Municipalidad de Rosario